ORBITALES ATOMICOS
Poco tiempo después de que Shrödinger hizo su propuesta en 1926, los seguidores de la mecánica cuántica eludieron dar una interpretación física precisa a la función de onda del electrón. Fue Max Born, unos cuantos meses después, quien indicó que podría darse un significado físico preciso al cuadrado de y . Si y2 es grande en una unidad de volumen del espacio, la probabilidad de encontrar un electrón en ese volumen es grande; se dice que la densidad de probabilidad es grande. A la inversa, si para otro volumen unitario de espacio es pequeña, la probabilidad de encontrar al electrón ahí es baja. Las gráficas de y2 en tres dimensiones generan las formas conocidas de los orbitales atómicos s, p, d y f.
Los orbitales s y p son, con mucho, los más importantes en la formación de las moléculas orgánicas, y nuestro estudio se limitará únicamente a éstos.
Un orbital es una región del espacio en donde la probabilidad de encontrar a un electrón es alta. Las formas de los orbitales s y p se muestran en las figuras siguientes. Existe una probabilidad finita, pero muy pequeña, de encontrar un electrón a mayores distancias del núcleo. Los volúmenes que se utilizan para ilustrar a un orbital, son aquellos que contendrán al electrón 90 a 95% del tiempo.
Ambos orbitales 1s y 2s son esferas (lo mismo que todos los orbitales s superiores). El signo de la función de onda, y1s, es positivo (+) en todo el orbital 1s. El orbital 2s contiene una superficie nodal, es decir, un área en donde y=0. En la posición interna del orbital 2s, y2s es negativa.

Los orbitales 2p tienen la forma de dos esferas que casi se tocan. El signo de fase de la función de onda, y2p ,es positiva en un lóbulo (o esfera) y negativa en el otro. El signo de fase se puede indicar con los símbolos + y -, pero para evitar confusiones con las cargas eléctricas, se prefiere usar dos colores o dos tonalidades, tal como se ha hecho. Un plano nodal separa a los dos lóbulos de un orbital p y los tres orbitales p se distribuyen en el espacio de manera que sus ejes se encuentran mutuamente perpendiculares.
No debe asociarse el signo de la función de onda con nada que tenga relación con carga eléctrica. Como se dijo antes, los signos (+) y (-) asociados con y son simplemente, los signos aritméticos de la función de onda en esa región del espacio. Estos signos no implican una menor o mayor probabilidad de encontrar un electrón en cualquiera de ellos. La probabilidad de encontrar un electrón es y2 y y2 siempre es positiva. (Al elevar al cuadrado un número negativo siempre se hace positivo). Por lo tanto, la probabilidad de encontrar al electrón en el lóbulo con signo (-) de un orbital p es la misma que la de que aparezca en el lóbulo (+). El significado de los signos (+) y (-) se hará más claro posteriormente cuando se observe cómo se combinan los orbitales atómicos para formar los orbitales moleculares formándose enlaces covalentes.
Existe una relación entre el número de nodos de un orbital y su energía: mientras mayor sea el número de nodos mayor será la energía. Puede verse un ejemplo aquí; los orbitales 2s y 2p tienen un nodo cada uno y tienen mayor energía que un orbital 1s, que no tiene nodos.
Las energías relativas de los orbitales de menor energía son las siguientes. Los electrones en los orbitales 1s tienen la menor energía porque son los más cercanos al núcleo positivo. Los electrones en los orbitales 2s son los de siguiente nivel más bajo de energía. Los electrones de los orbitales 2p tienen una energía igual pero más alta. (Se dice que los orbitales de igual energía son orbitales degenerados).
Estas energías relativas se pueden utilizar para deducir la configuración electrónica de cualquier átomo, en los primeros dos renglones de la tabla periódica. Tan sólo es necesario seguir unas cuantas reglas simples.
1. El principio de aufbau: Los orbitales se llenan de manera que primero se completan los de menor energía (Aufbau: es la palabra alemana que significa "construcción").
2. El principio de exclusión de Pauli: En todo orbital se pueden colocar un máximo de dos electrones pero sólo cuando los espines de los electrones están apareados. Un electrón gira sobre su propio eje. Por razones que aquí no podemos deducir, a un electrón sólo se le permite una u otra de las dos únicas orientaciones posibles de rotación (espín). Por lo general estas orientaciones se muestran como flechas, ya sea h o i. Por lo tanto, dos electrones de espín apareado se representarán como hi. Los electrones no apareados, que no pueden coexistir en el mismo orbital, se representan como hh (o ii).
3. La regla de Hund: Cuando se trata con orbitales de igual energía (orbitales degenerados) como los tres orbitales p, se agrega un electrón a cada uno, teniendo sus direcciones de rotación (espines) no apareadas, hasta que cada uno de los orbitales degenerados contenga un electrón. Después se empieza a agregar un segundo electrón a cada orbital degenerado, de tal manera que quedan apareados los sentidos de rotación.
Si se aplican estas reglas a ciertos elementos del segundo renglón de la tabla periódica, se obtienen los resultados que aparecen en la siguiente figura.
Existen dos teorías para describir el enlace covalente utilizando el concepto de orbital, la teoría del enlace de valencia (EV) y la teoría de los orbitales moleculares (OM). Ambas teorías son complementarias y la utilización de una u otra es más o menos adecuada según el aspecto del enlace que se desea destacar.
Son combinación de orbitales puros para que los enlaces sean equivalentes.
para saber el tipo de hibridación hay que ver cuantos enlaces presentará el C:
CE C = 1s² 2s² 2px¹ 2py¹ 2pzº
el C tiene 4e- en su orbital de valencia: tiene 2e- en un orbital s, 2e- en 2 orbitales p y tiene 1 orbital p vacío.
- en alcanos, hay sólo uniones simples C-C y C-H. ejemplo en el metano:
...H
....I
H-C-H
....I
...H
como los enlaces son equivalentes, y se unirá a 4 átomos, necesitará 4 orbitales híbridos, que resultan de combinar 1 orbital s con 3 orbitales p: pasa a tener 4 orbitales sp³ (el 3 indica el nº de orbitales p involucradas). lo que sucede, es que pasa un e- del subnivel 2s al pz, quedando 4 orbitales sp³ de igual energía con un electrón cada uno, y cada uno de esos orbitales se va a solapar con el orbital s de un H, generandose un enlace simple llamado sigma (se llama así porque el solapamiento es frontal) entre C e H.
en el metano habrá:
- 4 enlaces sigma: cada uno se da entre el orbital s del H y un orbital sp³ del C.
en los alquenos, hay enlaces C=C. ejemplo en el eteno:
H......H
..\...../
..C=C
../.....\
H......H
cada C se unirá a 3 átomos, por lo que necesitará 3 orbitales híbridos sp²: se combinan el s y 2 orbitales p, quedando un p puro que se solapará lateralmente con el p puro del otro C para formar el enlace pi (el doble enlace). se logra pasando los electrones de la misma manera que el anterior, pero quedan 3 orbitales híbridos sp² y un p puro con 1e-.
las uniones para el eteno serán:
- 4 enlaces sigma: cada una se da entre el orbital s del H y un orbital sp² del C.
- 1 enlace sigma entre 1 orbital sp² de un C con y otro sp² del otro C.
- 1 enlace pi entre un orbital p puro de un C con el p puro del otro.
en los alquinos, como el acetileno:
H-C≡C-H
los C se unen a 2 átomos, así que necesitarán 2 orbitales híbridos sp: se combinan el orbital 2s con el 2px y quedan 2 orbitales p puros (py y pz). los enlaces del acetileno serán:
- 2 enlaces sigma: cada uno se da entre el orbital s de un H y un orbital sp de un C.
- 1 enlace sigma entre 1 orbital sp de un C con el sp del otro C.
- 1 enlace pi entre el orbital py de un C con el py del otro.
- 1 enlace pi entre el orbital pz de un C con el pz del otro.
GEOMETRIA DE LOS ENLACES SENCILLOS,DOBLES Y TRIPLES
La Química del carbono es la parte de la química que estudia sustancias compuestas casi en su totalidad de carbono e hidrógeno, y que a veces contienen pequeñas cantidades de otros elementos, como oxígeno, notrógeno, azufre o halógenos. Estos compuestos se denominan compuestos orgánicos porque se encuentran sobre todo en los seres vivos, y la parte de la Química que se ocupa de su estudio se denomina Química Orgánica.
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
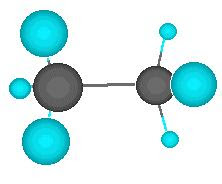
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.
A la derecha tienes una simulación en la que puedes girar la molécula arrastrando mientras pulsas el botón izquierdo del ratón, y ampliarla arrastranso mientras pulsas el botón derecho.
Pero el átomo de carbono puede formar enlaces con otros átomos de carbono, originando cadenas que puieden ser larguísimas. El ejemplo más simple de esto es un átomo de carbono que se une a tres hidrógenos y a otro carbono, que a su vez se une a otros tres hidrógenos. En este compuesto, de nombre etano, los dos carbonos actúan de forma tetragonal.
Enlace doble
El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otrs dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal.
El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que les quedan a cada uno los comparten con dos átomos de hidrgeno. La estructura es trigonal y plana.
También puede el carbono formar el enlace doble con otros elementos, entre ellos el nitrógeno y el oxígeno, como veremos más adelante.
Enlace triple
Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.
El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que les queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal. También puede el carbono formar el enlace triple con otros elementos como el nitrógeno.
TETRAVALENCIA DEL CARBONO
El átomo de carbono se localiza en la tabla periódica en el grupo IV A.
Su configuración electrónica es:
C6 = 1s2, 2s2, 2p2
Su modelo atómico (Bohr) es el siguiente:
este modelo se deduce que la valencia del carbono es 4 y por eso se llama tetravalente. No acepta ni dona electrones, sino que los comparte al combinarse, formando enlaces covalentes.
La hibridación es un reacomodo espacio energético de orbitales atómicos puros, de esta manera forman una geometría de enlace más eficaz. (Todos los elementos de la tabla periódica, exceptuando al hidrógeno y los gases nobles, presentan el fenómeno de hibridación).
Los cuatro electrones de este orbital híbrido nos dan las cuatro valencias del carbono, las que se dirigen a los cuatro vértices de un tetraedro regular, presentando un ángulo de 109° 28'.
Estructura tetragonal híbrida del carbono
En general los orbitales moleculares pueden ser: orbitales sigma y orbitales.
En los alcanos, entre carbono y carbono presenta enlaces sencillos llamados sigma. En los alquenos presenta al menos un enlace doble, en donde uno de los enlaces es sigma y otro es enlace . En en los alquinos prencenta almenos un triple enlace en donde, un enlace es sigma y los otros dos son enlaces , como en el caso de la molécula del acetileno (etino).
REPRESENTACION DE LA FORMULAS QUIMICAS ORGANICAS
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura o formulación química. Existen varios tipos de fórmulas químicas:1
FORMULA DESARROLLADA O ESTRUCTURAL
este tipo de formulas expresan la cantidad de átonos que existen en una molécula, es decir, que te ponen todos los átomos tal cual van en la formula, es como dibujar una figura geométrica con todos sus lados.
La fórmula semidesarrollada muestra todos los átomos que forman una molécula covalente, y los enlaces entre átomos de carbono (en compuestos orgánicos) o de otros tipos de átomos.1 No se indican los enlaces carbono-hidrógeno. Es posiblemente la fórmula química más empleada aunque no permite ver la geometría real de las moléculas.
Una fórmula semidesarrollada es una simplificación de una fórmula desarrollada, en la cual no se representan los enlaces carbono-hidrógeno.
Por ejemplo, el octano tiene como fórmula molecular C8H18 :
Fórmula desarrollada :
Fórmula semidesarrollada :
CH3 − CH2 − CH2 − CH2 − CH2 − CH2 − CH2 − CH3
También se pueden invertir los átomos de C y de H para resaltar los enlace carbono-carbono, como por ejemplo para el propano, C3H8 : H3C − CH2 − CH3
También se puede respetar la geometría de la molécula, respetando por ejemplo los ángulos de 120° de ciertas moléculas.
Ejemplos de fórmulas semidesarrolladas en Química orgánica
• El etano C2H6 :
• El etanol C2H6O :
• El ácido acético (o ácido etanoico) CH3-COOH) :
• El 2-metilpropano C4H10 :
La fórmula molecular es la fórmula química que indica los números de átomos distintos presentes en la molécula. Ésta es la máxima expresión ya que la fórmula molecular es la cantidad real de átomos que conforman una molécula. y la empirica es la cantidad disminuida del átomo y se halla de la siguiente forma: con el peso de todo el elemento y con el suma del compuesto se divide el peso del elemento por el suma y así se halla la formula molecular. La fórmula molecular coincide a veces con la fórmula empírica; otras veces es un múltiplo entero de esta fórmula. Se expresa como:
Donde es un número entero.
La fórmula molecular se da por (fórmula mínima) n= Fórmula molecular













No hay comentarios:
Publicar un comentario