sistema IUPAC, se basa en una serie de reglas muy sencillas que permiten nombrar
cualquier compuesto orgánico a partir de su fórmula desarrollada, o viceversa. Esta es
la "nomenclatura sistemática". Además existe la "nomenclatura vulgar", que era el
nombre por el que se conocían inicialmente muchas moléculas orgánicas (como p.e.
ácido acético, formaldehído, estireno, colesterol, etc), y que hoy día está aceptada.
El nombre sistemático está formado por un prefijo, que indica el número de átomos de
carbono que contiene la molécula, y un sufijo, que indica la clase de compuesto
orgánico de que se trata. Algunos de los prefijos más utilizados son:
CLASES DE ÁTOMOS DE CARBONO
Alcanos Acíclicos Lineales
Son hidrocarburos saturados de cadena abierta. Se nombran con un prefijo que indica el número de átomos de carbono y el sufijo –ano. Se representan dibujando la cadena hidrocarbonada en la que cada átomo de carbono se une al siguiente con enlaces sencillos y se completa con los átomos de hidrógeno correspondientes a la tetravalencia propia del átomo de carbono.
Ejemplos:
Alcanos Acíclicos Ramificados
Son iguales que los anteriores pero con sustituyentes que constituyen las ramificaciones. El nombre del hidrocarburo se forma con los nombres de los sustituyentes por orden alfabético, añadiendo al final, sin separación, el nombre de la cadena principal. Varias cadenas laterales idénticas se nombran con prefijos di-, tri-, tetra-, etc.
Para ello se siguen las reglas de la IUPAC:
a) Localizar la cadena principal: la que tenga mayor longitud. A igual longitud, la que tenga mayor número de sustituyentes.
b) Numerar la cadena principal. Utilizar la numeración que asigne los números más bajos a los sustituyentes. A iguales combinaciones, se escoge la menor numeración por orden alfabético de sustituyentes.
c) Nombrar las cadenas laterales como grupos alquilo precedidos por su localizador separado por un guión.
La representación de estos compuestos a partir de su nombre sistemático se hace dibujando la cadena principal, numerándola e identificando los sustituyentes con sus respectivos localizadores.
Ejemplos:
Alcanos Cíclicos
Son hidrocarburos saturados de cadena cerrada. Se nombran igual que los de cadena abierta pero anteponiendo el prefijo ciclo. Se representan de la misma manera que los de cadena abierta y se pueden omitir los símbolos de C e H que se suponen localizados en los vértices de la figura.
Ejemplos:
Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo.
ALQUENOS
Se llaman alquenos a los hidrocarburos que tienen uno o más dobles enlaces. Se nombran igual que los alcanos pero terminan en -eno, y se indica la posición del doble enlace con el localizador más bajo posible. Se representan dibujando la cadena hidrocarbonada señalando el o los dobles enlaces y se completa con los átomos de hidrógeno correspondientes a la tetravalencia propia del átomo de carbono. Si hay ramificaciones, se toma como cadena principal la más larga de las que contienen al doble enlace y se comienza a numerar por el extremo más próximo al doble enlace. Cuando existe más de un doble enlace, la terminación es -dieno, -trieno, etc.
Ejemplos:
ALQUINOS
Se llaman alquinos a los hidrocarburos que tienen uno o más triples enlaces. Se nombran igual que los alcanos pero terminan en -ino, y se indica la posición del triple enlace con el localizador más bajo posible. Se representan dibujando la cadena hidrocarbonada señalando el o los triples enlaces y se completa con los átomos de hidrógeno correspondientes a la tetravalencia propia del átomo de carbono. Si hay ramificaciones y/o más de un triple enlace, la nomenclatura es análoga a la de los alquenos. La cadena se nombra de forma que los localizadores de las insaturaciones sean lo más bajos posible. Cuando hay dobles y triples enlaces en la cadena, la terminación del compuesto debe corresponder a la del triple enlace, es decir, ino.
Ejemplos:
HIDROCARBUROS AROMÁTICOS
Se trata, fundamentalmente, de derivados del benceno mono y polisustituídos.
Para bencenos monosustituídos, el localizador nº 1 se asigna al carbono con el sustituyente. Para bencenos polisustituídos, se siguen las mismas normas que para los cicloalcanos. Los sustituyentes en posiciones 1,2-, 1,3-, 1,4-, pueden nombrarse con los prefijos o- (orto), m- (meta) y p- (para). Cuando el anillo bencénico es un sustituyente se le denomina fenil.
Ejemplos:
El benceno es un hidrocarburo poliinsaturado de fórmula molecular C6H6, con forma de anillo (se le llama anillo bencénico, o aromático, ya que posee un olor característico) y puede considerarse una forma poliinsaturada del ciclohexano. En el benceno cada átomo de carbono ocupa el vértice de un hexágono regular, ocupa dos valencias con los dos átomos de carbonos adyacentes, una tercera valencia con un átomo de hidrógeno y la cuarta denominada 'oculta' dirigiéndola hacia el centro del anillo hexagonal formada en algunos casos de carbono y en otros de alguna base nitrogenada. Cada átomo de carbono comparte su electrón libre con toda la molécula (según la teoría de orbitales moleculares), de modo que la estructura molecular adquiere una gran estabilidad y elasticidad. El benceno es un líquido incoloro y muy inflamable de aroma dulce, con un punto de fusión relativamente alto.
Del benceno se derivan otros hidrocarburos de este tipo entre los que se encuentran: el tolueno, el orto-xileno, el meta-xileno y el para-xileno y otros llamados polinucleicos que son el naftaleno, el fenantreno, antraceno y el pireno
DERIVADOS HALOGENADOS DE LOS HIDROCARBUROS
Son hidrocarburos que contienen en su molécula átomos de halógeno.
Se nombran anteponiendo el nombre del halógeno (fluoro, cloro, bromo, yodo) al del hidrocarburo correspondiente. La posición de los átomos de halógeno se indica por medio de localizadores.
Ejemplos:
Si existen dobles y triples enlaces, se numera la cadena de modo que a las instauraciones les correspondan los localizadores más pequeños.
Al nombrar los derivados halogenados de cadena ramificada, los halógenos se consideran como radicales y se citan en el lugar que les corresponde según el orden alfabético.
Ejemplos:
ALCOHOLES, FENOLES Y ÉTERES
Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al
agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo
funcional es el grupo hidroxilo, OH.
Los fenoles tienen el mismo grupo funcional, pero unido a un anillo aromático Ar -OH.
Los éteres tienen de formula general R - O - R', donde R y R' pueden ser grupos
idénticos o diferentes y pueden ser grupos alquilo o arilo.
Nomenclatura de Alcoholes. Los alcoholes, al igual que los halogenuros de alquilo, se
clasifican o dividen en primarios, secundarios y terciarios, según el número de grupos
hidrocarbonados unidos al átomo de carbono al que va enlazado el grupo hidroxilo.
En la nomenclatura de alcoholes se suelen emplear nombres vulgares para los
términos más sencillos ( C1 - C4 ). Estos nombres se forman con la palabra alcohol.
Ejemplos:
El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
1. Se busca la cadena más larga que incluya el grupo hidroxilo. La terminación o del
hidrocarburo se cambia por -ol.
2. La cadena se numera de forma que al grupo funcional le corresponda el menor
número posible. Si hay mas de un grupo hidroxilo en la cadena, se emplean los
prefijos di, tri, etc.
3. Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi,
precedido de su número localizador
Ejemplos:
Nomenclatura de fenoles. Para nombrar los fenoles se utiliza, como en los alcoholes el
sufijo -ol al nombre del hidrocarburo aromático. Los fenoles se nombran con mayor
frecuencia como derivados del fenol. Los otros sustituyentes del anillo se localizan con
un número o mediante los prefijos orto, meta, para.
Ejemplos:
El grupo hidroxilo también se nombra como sustituyente cuando se encuentra
presente en la misma molécula un ácido carboxílico, un aldehido o alguna cetona, ya
que tienen prioridad en la nomenclatura.
Ejemplos:
Nomenclatura de Eteres: Los éteres se denominan generalmente con el nombre de
cada uno de los grupos alquilo o arilo, en orden alfabético, seguidos de la palabra eter.
Ejemplos:
En el caso de éteres con estructuras más complejas, se nombra según la IUPAC
considerando que uno de los radicales (el mayor si se trata de un éter asimétrico) es
un hidrocarburo que lleva como sustituyente el grupo alquilo pequeño con el oxigeno,
al que se denomina grupo alcoxi.
Ejemplos:
ALDEHÍDOS Y CETONAS
Son compuestos cuyo grupo funcional se conoce como grupo carbonilo y está formado
por un carbono y un oxígeno unidos por enlace múltiple:
Cuando el grupo carbonilo se encuentra en un extremo de la cadena, tenemos los
aldehídos y, en ese caso el carbono estará unido a un átomo de hidrógeno y a una
grupo alquilo o arilo. Y, cuando el grupo carbonilo se encuentra dentro de la cadena
tendremos las cetonas y el carbono estará unido por ambos lados a grupos alquilo o
arilo.
Para nombrar los aldehídos se utiliza el nombre del hidrocarburo con igual número de
átomos de carbono y el sufijo -al. Los aldehídos más sencillos se nombran también por
el nombre vulgar del ácido carboxílico correspondiente, eliminando la palabra ácido y
sustituyendo el sufijo -ico ó -oico por el sufijo -aldehído. Cuando en un compuesto hay
otras funciones que tienen prioridad sobre la función aldehído, se utiliza el prefijo
formil- para designar al grupo CHO, al que se le considera entonces como un
sustituyente.
Para nombrar las cetonas se utiliza, en lugar del sufijo -al el sufijo -ona Las más
sencillas también se conocen por el nombre vulgar que consiste en nombrar los dos
radicales unidos al grupo carbonilo seguidos de la palabra cetona. Mientras que la
posición del grupo aldehído no es necesario indicarla (por encontrarse siempre en un
extremo), la del grupo cetona si puede ser necesario; en este caso se numera la
cadena principal comenzando por el carbono más próximo al de la cetona, de manera
que al grupo carbonilo le corresponda el número más bajo posible. La cetona más
sencilla, la propanona, conserva el nombre vulgar acetona.
En aquellos casos en que la función cetona no es el grupo principal, para indicar el
grupo CO se emplea el prefijo oxo-.
Ejemplos:
ACIDOS CARBOXÍLICOS
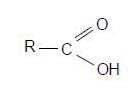
Están formados por carbono, hidrógeno y oxígeno y su fórmula general es
Es el grupo funcional de mayor importancia. Para nombrar estos compuestos se
considera como cadena principal la mayor número de átomos de carbono que
contenga el grupo ácido y se numera empezando por el carbono del grupo carboxílico.
Se utiliza como prefijo el nombre del hidrocarburo con igual número de átomos de
carbono y como sufijo la terminación -ico ó -oico, todo ello precedido de la palabra ácido. Entre los ácidos carboxílicos existen muchos que se conocen por su nombre
vulgar.
Ejemplos:
En aquellos casos en que el nombre sistemático no sea cómodo (generalmente
cuando hay radicales cíclicos o en el caso de existir varios grupos ácidos en la
molécula) se considera el grupo carboxílico como sustituyente y se nombra utilizando
el prefijo carboxi- o el sufijo -carboxílico.
Los ácidos carboxílicos aromáticos se nombran igual que los alifáticos. En caso de que
haya sustituyentes en el anillo aromático, se numeran los átomos de carbono dando el
número 1 al del grupo carboxílico y al resto de tal forma que los sustituyentes tengan
los números más bajos posibles.
Ejemplos:
Los radicales de los ácidos carboxílicos se obtienen al eliminar el grupo hidroxilo y
reciben el nombre de radicales acilo. Se nombran sustituyendo el sufijo -ico por el
sufilo -ilo y quitando la palabra ácido.
Ejemplos:
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
ANHIDRIDOS DE ACIDO
Son también derivados de los ácidos carboxílicos. Para
nombrarlos, si son simétricos, se sustituye la palabra ácido por la palabra anhídrido y
el resto se deja igual.
Ejemplo:
Si se trata de un anhídrido mixto se nombran los dos ácidos de los que deriva
anteponiendo la palabra anhídrido.
Ejemplo:
HALUROS DE ÁCIDO
Son derivados de los ácidos carboxílicos en los que se ha
sustituido el grupo -OH del ácido por un átomo de halógeno. Para nombrarlos se
sustituye el sufijo -ico por la terminación -ilo y la palabra ácido por el nombre del
haluro correspondiente.
Ejemplos:
Compuestos ácidos y derivados importantes
El ácido acético también es mejor conocido como ácido metilencarboxílico, se puede encontrar en forma de ión acetato. Éste es un ácido que se encuentra en el vinagre, siendo el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH (C2H4O2). De acuerdo con la IUPAC se denomina sistemáticamente ácido etanoico
El ácido cítrico es un ácido orgánico tricarboxílico que está presente en la mayoría de las frutas, sobre todo en cítricos como el limón y la naranja. Su fórmula química es C6H8O7.
Es un buen conservante y antioxidante natural que se añade industrialmente como aditivo en el envasado de muchos alimentos como las conservas de vegetales enlatadas.
En bioquímica aparece como un metabolito intermediario en el ciclo de los ácidos tricarboxílicos, proceso realizado por la mayoría de los seres vivos.
El nombre IUPAC del ácido cítrico es ácido 2-hidroxi-1,2,3-propanotricarboxílico.
El ácido gálico es un ácido orgánico también conocido como ácido 3,4,5-trihidroxibenzoico, que se encuentra en las agallas, en las hojas de té, en la corteza de roble y otras plantas. La fórmula química es C6H2(OH)3COOH. El ácido gálico se encuentra tanto en su forma libre como formando parte de taninos. Las sales y los ésteres del ácido gálico se denominan galatos. Su nombre se refiere a las agallas donde se lo encuentra y no al elemento galio.
El ácido succínico, denominado mediante la nomenclatura (IUPAC: ácido butanodioico) es un ácido dicarboxílico con la fórmula:
HOOC–CH2–CH2–COOH (C4H6O4) En forma de anión succinato, interviene en el ciclo de Krebs, reduciendo el coenzima FAD y permitiendo así la consecución de energía por fosforilación oxidativa, tras la cesión de electrones a intermediarios de la cadena de transporte de electrones, según la reacción siguiente:
succinato + FAD → fumarato + FADH2
El ácido cis-butenodioico o (Z)-ácido butenodioico o ácido maleico, es un compuesto orgánico que es un dicarboxílico (molécula con dos grupos carboxilo). Otros nombres con el que se le conoce a este ácido son el ácido malénico, el ácido maleinico y ácido toxilico.
EL ácido maleico es el isómero del ácido cis-butenodioico, mientras que el ácido fumárico es el isómero trans.



































No hay comentarios:
Publicar un comentario