Dos enantiómeros de un aminoácido genérico
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico o quiral, es decir, un átomo de carbono con cuatro sustituyentes diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas o formas quirales, aunque todos los átomos están en la misma posición y enlazados de igual manera. Esto se conoce como regla de Level y Van't Hoff.1
Los isómeros ópticos no se pueden superponer y uno es como la imagen especular del otro, como ocurre con las manos derecha e izquierda. Presentan las mismas propiedades físicas y químicas pero se diferencian en que desvían el plano de la luz polarizada en diferente dirección: uno hacia la derecha (en orientación con las manecillas del reloj) y se representa con la letra (D) o el signo (+)(isómero dextrógiro o forma dextro) y otro a la izquierda (en orientación contraria con las manecillas del reloj)y se representa con la letra (L) o el signo (-)(isómero levógiro o forma levo).4
Formas R y S del bromoclorofluorometano.
Si una molécula tiene n átomos de Carbono asimétricos, tendrá un total de 2n isómeros ópticos.
También pueden representarse estos isómeros con las letras (R) y (S). Esta nomenclatura se utiliza para determinar la configuración absoluta de los carbonos quirales.
Así pues,hay tres sistemas de nombrar estos compuestos: según la dirección de desviación del plano de la luz polarizada (Formas + y -); según la configuración (Formas D y L) y según la configuración absoluta (formas R y S).
Diasteroisómeros
Artículo principal: Diastereoisómero
Cuando un compuesto tiene más de un carbono asimétrico podemos encontrar formas enatiómeras (que son imagen especular una de la otra) y otras formas que no son exactamente copias espaculares, por no tener todos sus carbonos invertidos. A estas formas se les llama diasteroisómeros. Por ejemplo, el 3-bromo-butan-2-ol posee dos carbonos asimétricos por lo que tiene 4 formas posibles. De ellas, algunas son enantiomorfas (formas especulares), como (2S,3S)-3-bromo-butan-2-ol y (2R,3R)-3-bromo-butan-2-ol. En cambio, (2R,3S)-3-bromo-butan-2-ol es un diastereoisómero de los dos anteriores.
Mezcla racémica y formas meso.
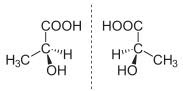
Enantiómeros del ácido láctico o 2-hidroxipropanoico
Una mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva.
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de forma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico Es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de anchura. Es el mismo para ambos enantiómeros, aunque de signo contrario. Se mide con el polarímetro.5
ENANTIOMORFOS
Los complejos de geometría tetraédrica presentan isómeros ópticos si los cuatro
ligandos unidos al átomo metálico central son diferentes. Pero la isomería óptica se
observa también en aquellos complejos de geometría octaédrica que poseen ligandos
bidentados o quelatantes.
En el caso de una molécula con un sólo átomo de carbono asimétrico son posibles dos
configuraciones distintas y tales que una cualquiera de ellas es la imagen especular de la
otra. Estas configuraciones son recíprocamente enantiomorfas.
Los enantiomorfos son isómeros ópticos, pues teniendo la misma fórmula molecular
sólo se diferencian en su acción sobre la luz polarizada. Los enantiomorfos presentan
las mismas propiedades químicas y físicas (excepto su acción sobre la luz polarizada).
Una mezcla equimolecular (igual número de moléculas) de dos enantiomorfos no
presentará actividad óptica. A esta mezcla se le llama mezcla racémica.
Ejemplo de enantiómeros: (R) y (S)-1-Bromo-1-cloroetano
En los modelos moleculares puede verse que las dos moléculas son distintas, no se
superponen.
Isómeros conformacionales
Los enlaces simples entre átomos tienen simetría cilíndrica y permiten la rotación de los grupos que unen. Las diferentes disposiciones espaciales que adoptan los átomos como consecuencia de la rotación en torno al enlace se llaman conformaciones. Una conformación concreta de las múltiples posibles se denomina confórmero.
La rotación del enlace carbono-carbono en el etano da lugar a dos conformaciones límite -la conformaciones alternada (con los hidrógenos alternados) y la conformación eclipsada (con los hidrógenos enfrentados-. El paso de la conformación alternada a la eclipsada o viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen infinitas conformaciones posibles
La rotación en torno al enlace simple oxígeno-oxígeno en la molécula de agua oxigenada genera tres conformaciones de especial importancia. La conformación que tiene los hidrógenos enfrentados se llama SIN. Cuando los hidrógenos se sitúan a lados opuestos se habla de confórmero ANTI. La conformación que deja los hidrógenos a 60º recibe el nombre de Gauche.






No hay comentarios:
Publicar un comentario