Es un método por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una centrifugadora, la cual imprime a la mezcla un movimiento rotatorio con una fuerza de mayor intensidad que la gravedad, provocando la sedimentación del sólido o de las partículas de mayor densidad. Este es uno de los principios en los que se basa la densidad: Todas las partículas, por poseer masa, se ven afectadas por cualquier fuerza (origen de una aceleración). La centrifugación impone, gracias a la aceleración centrífuga, un efecto parecido al gravitacional: Las partículas experimentan una aceleración que las obliga a sedimentar. La centrifugación puede dividirse en primera instancia en dos grandes grupos: La preparativa y la analítica. En la primera, se obtienen grandes cantidades del material que se desea estudiar, mientras que en la segunda se procede al análisis de las macromoléculas en una ultracentrifugación. Existen diversos métodos de centrifugación y una extensa variedad de técnicas derivadas de esta.
El objetivo de la centrifugación es separar partículas de diferentes características. Para ello, se aplica un fuerte campo centrífugo, con lo cual las partículas tenderán a desplazarse a través del medio en el que se encuentren con la aceleración G.
G=velocidad angular2 x radio de giro. O otra formula es G=velocidad
angular + radio
Componentes de la centrífuga
Una ce nt r if uga es un dispositivo para separar partículas en una solución de acuerdo a su tamaño, textura, densidad, viscosidad del medio y velocidad del rotor.
Centrifugación en gradiente de densidad
Este método es algo más complicado que la centrifugación diferencial, sin embargo presenta ventajas que compensan el trabajo añadido. La técnica no solo permite la separación de varios, si no todos, los componentes de la muestra, sino que también permite realizar medidas analíticas.
El método de gradiente de densidad implica la utilización de un so po rte
fluido, cuya densidad aumenta desde la zona superior a la inferior. El
gradiente se consigue con un soluto preferiblemente de baja masa
molecular en un solvente en el que la muestra a analizar pueda ser suspendida. La muestra se sitúa en la parte superior del gradiente como una fina banda. La separación de los componentes de la muestra se presenta como diferentes bandas o zonas. Existen dos variaciones dentro de la centrifugación en gradiente de densidad:
Centrifugación zonal: La muestra a analizar se deposita en la parte
superior de un gradiente de densidad preformado. Bajo fuerza centrífuga
las partículas comenzarán a sedimentar a través del gradiente, moviéndose cada partícula a diferentes velocidades dependiendo de su masa.
-Centrifugación de equilibrio en gradiente o isopícnica: Separa las
partículas con base en sus densidades diferentes, la muestra puede ser cargada directamente sobre un gradiente de densidad preformado y la centrifugación llevada a cabo. Mientras en la centrifugación zonal la densidad del gradiente no debe exceder a la de las partículas a separar, en la centrifugación de equilibrio en gradiente la condición fundamental es que la densidad máxima del gradiente final debe siempre exceder a la densidad de las partículas.
La centrifugación de equilibrio en gradiente permite que las especies sedimentantes se muevan por el gradiente hasta que alcanzan un punto donde su densidad y la del gradiente son idénticas, por lo cual también se le llama centrifugación isopícnica. En este punto no se producirá una sedimentación posterior debido a que flotan sobre un "colchón" de material que posee una densidad superior que la suya propia
Centrifugación diferencial
Es el método más común de separación, y es rara la purificación enzimática que no lo utiliza. En este método, el tubo de centrífuga se llena con una mezcla uniforme problema. Tras la centrifugación se obtienen dos fracciones: un pellet que contiene el material sedimentado y un sobrenadante con el material no sedimentado. El método es bastante inespecífico, y a priori no se puede saber si la partícula buscada quedará en el sobrenadante, en el pellet o repartido entre ambos; sin embargo es una técnica muy útil, sobre todo para aislamiento de células y orgánulos subcelulares.
ULTRACENTRIFUGACIÓN
Permite estudiar las características de sedimentación de estructuras subcelulares como Lisosomas, Ribosomas y Microsomas y biomoléculas. Utiliza rotores especiales (fijos o de columpio) y sistemas de monitoreo. Existen diferentes maneras de monitorear la sedimentación de las partículas en la ultracentrifugación, el más común de ellos mediante luz UV o INTERFERONES.
Quimica ll
domingo, 25 de julio de 2010
ESPECTROFOTOMETRIA
INMUNODETECCION ELISA
El método de ELISA se fundamenta en el uso de anticuerpos específicos para capturar a la proteína de interés. Este procedimiento es capaz de discriminar proteínas específicas presentes en el producto bajo análisis, de entre cientos de proteínas distintas presentes en la misma muestra. El método de ELISA es extremadamente sensible, versátil y cuantitativo. En general, este procedimiento, incluye el uso de anticuerpos que se unen de manera específica a las proteínas de interés (llamados anticuerpos primarios), por ejemplo a aquellas que son sintetizadas como resultado de la introducción del nuevo ADN (llamadas proteínas transgénicas). Una reacción colorimétrica o fluorimétrica desencadenada por un segundo anticuerpo (o anticuerpo secundario) permite visualizar y medir la cantidad de la proteína de interés. El resultado se compara con la señal emitida por concentraciones conocidas de la misma proteína, por lo que el ensayo no solo es cualitativo, si no también cuantitativo. Una restricción para el uso de pruebasde ELISA en la detección de proteínas transgénicas es la desnaturalización de estas durante el procesamiento del alimento. Los resultados de esta prueba se estima que son confiables en un 95% de los casos sometidos ( Ausubel y cols., 1995). Todos los ELISAs detectan un rasgo genéticamente modificado, pero no todos los rasgos pueden ser detectados o diferenciados por un ELISA
El método de ELISA se fundamenta en el uso de anticuerpos específicos para capturar a la proteína de interés. Este procedimiento es capaz de discriminar proteínas específicas presentes en el producto bajo análisis, de entre cientos de proteínas distintas presentes en la misma muestra. El método de ELISA es extremadamente sensible, versátil y cuantitativo. En general, este procedimiento, incluye el uso de anticuerpos que se unen de manera específica a las proteínas de interés (llamados anticuerpos primarios), por ejemplo a aquellas que son sintetizadas como resultado de la introducción del nuevo ADN (llamadas proteínas transgénicas). Una reacción colorimétrica o fluorimétrica desencadenada por un segundo anticuerpo (o anticuerpo secundario) permite visualizar y medir la cantidad de la proteína de interés. El resultado se compara con la señal emitida por concentraciones conocidas de la misma proteína, por lo que el ensayo no solo es cualitativo, si no también cuantitativo. Una restricción para el uso de pruebasde ELISA en la detección de proteínas transgénicas es la desnaturalización de estas durante el procesamiento del alimento. Los resultados de esta prueba se estima que son confiables en un 95% de los casos sometidos ( Ausubel y cols., 1995). Todos los ELISAs detectan un rasgo genéticamente modificado, pero no todos los rasgos pueden ser detectados o diferenciados por un ELISA
CROMATOGRAFIAS
La cromatografia en capa fina
se basa en la preparación de una capa, uniforme, de un absorbente mantenido sobre una placa, la cual puede ser de vidrio, aluminio u otro soporte. Los requisitos son un absorbente, placas , un dispositivo que mantenga las placas durante la extensión, otro para aplicar la capa de absorbente, y una cámara en la que se desarrollen las placas cubiertas.
La fase móvil es líquida y la fase estacionaria consiste en un sólido. La fase estacionaria será un componente polar y el eluyente será por lo general menos polar que la fase estacionaria, de forma que los componentes que se desplacen con mayor velocidad serán los menos polares.
La Cromatografía líquida de alta eficacia o High performance liquid chromatography (HPLC) es un tipo de cromatografía en columna utilizada frecuentemente en bioquímica y química analítica. También se la denomina a veces Cromatografía líquida de alta presión o High pressure liquid chromatography (HPLC), aunque esta terminología se considera antigua y está en desuso. El HPLC es una técnica utilizada para separar los componentes de una mezcla basándose en diferentes tipos de interacciones químicas entre las sustancias analizadas y la columna cromatográfica.
La cromatografía de gases
es una técnica cromatográfica en la que la muestra se volatiliza y se inyecta en la cabeza de una columna cromatográfica. La elución se produce por el flujo de una fase móvil de gas inerte. A diferencia de los otros tipos de cromatografía, la fase móvil no interacciona con las moléculas del analito; su única función es la de transportar el analito a través de la columna.
Existen dos tipos de cromatografía de gases (GC): la cromatografía gas-sólido (GSC) y la cromatografía gas-líquido (GLC), siendo esta última la que se utiliza más ampliamente, y que se puede llamar simplemente cromatografía de gases (GC). En la GSC la fase estacionaria es sólida y la retención de los analitos en ella se produce mediante el proceso de adsorción. Precisamente este proceso de adsorción, que no es lineal, es el que ha provocado que este tipo de cromatografía tenga aplicación limitada, ya que la retención del analito sobre la superficie es semipermanente y se obtienen picos de elución con colas. Su única aplicación es la separación de especies gaseosas de bajo peso molecular. La GLC utiliza como fase estacionaria moléculas de líquido inmovilizadas sobre la superficie de un sólido inerte.
La GC se lleva a cabo en un cromatógrafo de gases. Éste consta de diversos componentes como el gas portador, el sistema de inyección de muestra, la columna (generalmente dentro de un horno), y el detector.
La espectrofotometría
es el método de análisis óptico más usado en las investigaciones químicas y biológicas. El espectrofotómetro es un instrumento que permite comparar la radiación absorbida o transmitida por una solución que contiene una cantidad desconocida de soluto, y una que contiene una cantidad conocida de la misma sustancia.
se basa en la preparación de una capa, uniforme, de un absorbente mantenido sobre una placa, la cual puede ser de vidrio, aluminio u otro soporte. Los requisitos son un absorbente, placas , un dispositivo que mantenga las placas durante la extensión, otro para aplicar la capa de absorbente, y una cámara en la que se desarrollen las placas cubiertas.
La fase móvil es líquida y la fase estacionaria consiste en un sólido. La fase estacionaria será un componente polar y el eluyente será por lo general menos polar que la fase estacionaria, de forma que los componentes que se desplacen con mayor velocidad serán los menos polares.
La Cromatografía líquida de alta eficacia o High performance liquid chromatography (HPLC) es un tipo de cromatografía en columna utilizada frecuentemente en bioquímica y química analítica. También se la denomina a veces Cromatografía líquida de alta presión o High pressure liquid chromatography (HPLC), aunque esta terminología se considera antigua y está en desuso. El HPLC es una técnica utilizada para separar los componentes de una mezcla basándose en diferentes tipos de interacciones químicas entre las sustancias analizadas y la columna cromatográfica.
La cromatografía de gases
es una técnica cromatográfica en la que la muestra se volatiliza y se inyecta en la cabeza de una columna cromatográfica. La elución se produce por el flujo de una fase móvil de gas inerte. A diferencia de los otros tipos de cromatografía, la fase móvil no interacciona con las moléculas del analito; su única función es la de transportar el analito a través de la columna.
Existen dos tipos de cromatografía de gases (GC): la cromatografía gas-sólido (GSC) y la cromatografía gas-líquido (GLC), siendo esta última la que se utiliza más ampliamente, y que se puede llamar simplemente cromatografía de gases (GC). En la GSC la fase estacionaria es sólida y la retención de los analitos en ella se produce mediante el proceso de adsorción. Precisamente este proceso de adsorción, que no es lineal, es el que ha provocado que este tipo de cromatografía tenga aplicación limitada, ya que la retención del analito sobre la superficie es semipermanente y se obtienen picos de elución con colas. Su única aplicación es la separación de especies gaseosas de bajo peso molecular. La GLC utiliza como fase estacionaria moléculas de líquido inmovilizadas sobre la superficie de un sólido inerte.
La GC se lleva a cabo en un cromatógrafo de gases. Éste consta de diversos componentes como el gas portador, el sistema de inyección de muestra, la columna (generalmente dentro de un horno), y el detector.
La espectrofotometría
es el método de análisis óptico más usado en las investigaciones químicas y biológicas. El espectrofotómetro es un instrumento que permite comparar la radiación absorbida o transmitida por una solución que contiene una cantidad desconocida de soluto, y una que contiene una cantidad conocida de la misma sustancia.
ACIDOS NUCLEICOS
Los ácidos nucleicos son macromoléculas, polímeros formados por la repetición de monómeros llamados nucleótidos, unidos mediante enlaces fosfodiéster. Se forman, así, largas cadenas o polinucleótidos, lo que hace que algunas de estas moléculas lleguen a alcanzar tamaños gigantes (de millones de nucleótidos de largo).
El descubrimiento de los ácidos nucleicos se debe a Friedrich Miescher, quien en el año 1869 aisló de los núcleos de las células una sustancia ácida a la que llamó nucleína, nombre que posteriormente se cambió a ácido nucleico.
Tipos de ácidos nucleicos
Existen dos tipos de ácidos nucleicos: ADN (ácido desoxirribonucleico) y ARN (ácido ribonucleico), que se diferencian:
por el glúcido (pentosa) que contienen: la desoxirribosa en el ADN y la ribosa en el ARN;
por las bases nitrogenadas que contienen: adenina, guanina, citosina y timina, en el ADN; adenina, guanina, citosina y uracilo, en el ARN;
en los organismos eucariotas, la estructura del ADN es de doble cadena, mientras que la estructura del ARN es monocatenaria, aunque puede presentarse en forma extendida, como el ARNm, o en forma plegada, como el ARNt y el ARNr, y
en la masa molecular: la del ADN es generalmente mayor que la del ARN.
Estructura del ADN
La información con la que se fabrican las moléculas necesarias para el mantenimiento de las funciones celulares está guardada en una molécula de ácido nucleico llamada ácido desoxirribonucleico (ADN). En este apartado describiremos su estructura y explicaremos cómo se almacena dentro del núcleo celular.
En la década de los cincuenta, el campo de la biología fue convulsionado por el desarrollo del modelo de la estructura del ADN. James Watson y Francis Crick en 1953 demostraron que consiste en una doble hélice formada por dos cadenas.
El ADN es un ácido nucleico formado por nucleótidos. Cada nucleótido consta de tres elementos:
un azúcar: desoxirribosa en este caso (en el caso de ARN o ácido ribonucleico, el azúcar que lo forma es una ribosa),
un grupo fosfato y
una base nitrogenada
Si la molécula tiene sólo el azúcar unido a la base nitrogenada entonces se denomina nucleósido.
Las bases nitrogenadas que constituyen parte del ADN son: adenina (A), guanina (G), citosina (C) y timina (T). Estas forman puentes de hidrógeno entre ellas, respetando una estricta complementariedad: A sólo se aparea con T (y viceversa) mediante dos puentes de hidrógeno, y G sólo con C (y viceversa) mediante 3 puentes de hidrógeno.
Los extremos de cada una de las hebras del ADN son denominados 5’-P (fosfato) y 3’–OH (hidroxilo) en la desoxirribosa. Las dos cadenas se alinean en forma paralela, pero en direcciones inversas (una en sentido 5’ → 3’ y la complementaria en el sentido inverso), pues la interacción entre las dos cadenas está determinada por los puentes de hidrógeno entre sus bases nitrogenadas. Se dice, entonces, que las cadenas son antiparalelas.
Figura 1. Estructura del ADN. El ácido desoxirribonucleico es un polímero de dos cadenas antiparalelas (orientación 5’ 3’ y 3’ 5’). Cada cadena está compuesta por unidades de un azúcar (desoxirribosa), un fosfato y una base nitrogenada unidas entre si por enlaces fosfodiéster. Las bases presentes en el ADN son: adenina (A), timina (T), citosina (C) y guanina (G). Para recordar cómo aparean entre sí las bases podemos pensar en las iniciales de dos grandes personajes del tango: Aníbal Troilo (adenina es la base complementaria de timina) y Carlos Gardel (citosina es la comlementaria a guanina).
Estructura primaria
El ADN está compuesto por una secuencia de nucleótidos formados por desoxirribosa. Las bases nitrogenadas que se hallan formando los nucleótidos de ADN son Adenina, Guanina, Citosina y Timina. No aparece Uracilo. Los nucleótidos se unen entre sí mediante el grupo fosfato del segundo nucleótido, que sirve de puente de unión entre el carbono 5' del primer nucleótido y el carbono 3' de siguiente nucleótido.
Como el primer nucleótido tiene libre el carbono 5' y el siguiente nucleótido tiene libre el carbono 3', se dice que la secuencia de nucleótidos se ordena desde 5' a 3' (5' → 3').
Estructura secundaria
La estructura secundaria del ADN fue propuesta por James Watson y Francis Crick, y la llamaron el modelo de doble hélice de ADN.
Este modelo está formado por dos hebras de nucleótidos. Estas dos hebras se sitúan de forma antiparalela, es decir, una orientada en sentido 5' → 3' y la otra de 3' → 5'. Las dos están paralelas, formando puentes de Hidrógeno entre las bases nitrogenadas enfrentadas.
Cuando en una hebra encontramos Adenina, en la otra hebra hallamos Timina. Cuando en una hebra encontramos Guanina, en la otra hallamos Citosina. Estas bases enfrentadas son las que constituyen los puentes de Hidrógeno. Adenina forma dos puentes de Hidrógeno con Timina. Guanina forma tres puentes de Hidrógeno con la Citosina.
Las dos hebras están enrolladas en torno a un eje imaginario, que gira en contra del sentido de las agujas de un reloj. Las vueltas de estas hélices se estabilizan mediante puentes de Hidrógeno.
Esta estructura permite que las hebras que se formen por duplicación de ADN sean copia complementaria de cada una de las hebras existentes.
Estructura terciaria
El ADN es una molécula muy larga en algunas especies y, sin embargo, en las células eucariotas se encuentra alojado dentro del minúsculo núcleo. Cuando el ADN se une a proteínas básicas, la estructura se compacta mucho.
Las proteínas básicas son Histonas o Protaminas.
La unión con Histonas genera la estructura denominada nucleosoma. Cada nucleosoma está compuesto por una estructura voluminosa, denominada core, seguida por un eslabón o "Linker". El core está compuesto por un octámero de proteínas, Histonas, denominadas H2A, H2B, H3 y H4. Cada tipo de histona se presenta en número par. Esta estructura está rodeada por un tramo de ADN que da una vuelta y 3/4 en torno al octámero. El Linker está formado por un tramo de ADN que une un nucleosoma con otro y una histona H1.
El conjunto de la estructura se denomina fibra de cromatina de 100Å. Tiene un aspecto repetitivo en forma de collar de perlas, donde las perlas serían los nucleosomas, unidos por los linker.
El ADN debe encontrarse más compacto en el núcleo de los espermatozoides. En este caso, el ADN se une a proteínas de carácter más básico, denominadas Protaminas. El ADN se enrolla sobre estas proteínas, formando una estructura muy compacta, denominada estructura cristalina del ADN.
DESNATURALIZACIÓN DEL ADN
Cuando la temperatura alcanza el punto de fusión del ADN, la agitación térmica es capaz de separar las dos hebras y producir una desnaturalización. Este es un proceso reversible, ya que al bajar la temperatura se puede producir una renaturalización. En este proceso se rompen los puentes de hidrógeno que unen las cadenas y se produce la separación de las mismas, pero no se rompen los enlaces fosfodiester covalentes que forman la secuencia de la cadena.
La desnaturalización del ADN puede ocurrir, también, por variaciones en el pH
Ácido ribonucleico
El ácido ribonucleico (ARN o RNA, de RiboNucleic Acid, su nombre en inglés) es un ácido nucleico formado por una cadena de ribonucleótidos. Está presente tanto en las células procariotas como en las eucariotas, y es el único material genético de ciertos virus (virus ARN). El ARN celular es lineal y de hebra sencilla, pero en el genoma de algunos virus es de doble hebra.
En los organismos celulares desempeña diversas funciones. Es la molécula que dirige las etapas intermedias de la síntesis proteica; el ADN no puede actuar solo, y se vale del ARN para transferir esta información vital durante la síntesis de proteínas (producción de las proteínas que necesita la célula para sus actividades y su desarrollo). Varios tipos de ARN regulan la expresión génica, mientras que otros tienen actividad catalítica. El ARN es, pues, mucho más versátil que el ADN.
El efecto hipercrómico
se utiliza para cuantificar la cantidad de ADN que se tiene en forma de doble hebra o de cadena sencilla. Al representar la temperatura frente a la absorción a 280 nm se observa una curva sigmoidea, con lo que se deduce que las fuerzas que estabilizan la estructura helicoidal son cooperativas, es decir, cuesta mucho romper las primeras interacciones estabilizantes, pero una vez conseguido el resto se rompe muy fácilmente. Hay un umbral mínimo de energía a partir del cual el proceso de desnaturalización es muy rápido.
La temperatura a la cual se ha conseguido separar el 50% de las hebras se llama temperatura de fusión TM (de melting: fusión en inglés), y da un valor representativo de la estabilidad de una secuencia determinada de ADN. Se ha comprobado que este valor depende de todos los factores que dan estabilidad al ADN, pero sobre todo depende de la cantidad de pares G•C que haya, es decir, de la cantidad de puentes de hidrógeno que se establezcan. Esto pone de relevancia que estos enlaces también contribuyen de manera importante a la estabilidad de la doble hélice o, más bien, que todos los procesos o características que estabilizan la estructura actúan conjunta y cooperativamente. Se ha caracterizado una relación lineal entre el porcentaje de G + C y la TM, de modo que ésta aumenta 0,4 ºC cada 1% más de G + C. En el hombre y los mamíferos el porcentaje medio de G + C es de un 40%, con lo que la temperatura de fusión ronda los 87 ºC, pero hay zonas del genoma, concretamente los promotores, en los que la proporción de G + C sube hasta un 60%, con lo que son zonas del ADN especialmente estables en las que la TM tiene un valor de hasta 95 ºC.
Electroforesis de ácidos nucleicos
No sólo las proteínas presentan carga y son solubles, también los ácidos nucleicos tienen la capacidad de migrar en un campo eléctrico y, por tanto, son susceptibles de ser separados por electroforesis, aunque con algunas variaciones con respecto de las proteínas:
• Son moléculas de mayor tamaño: Lo que implica que el tamaño de poro que nos da la acrilamida puede ser demasiado pequeño.
• Presenta gran cantidad de conformaciones y de tamaños: Lo que supone una gran variabilidad a la hora de diseñar los experimentos, ya que no es lo mismo separar cromosomas que simples nucleótidos.
En principio, es análoga a la electroforesis de proteínas en condiciones desnaturalizantes, salvo que aquí no hace falta el SDS para conferir la misma relación carga/masa es todas las moléculas (aunque se utiliza en el tampón de carga), ya que en los ácidos nucleicos la parte que confiere la carga es el grupo fosfato, y está presente de forma regular en la estructura.
En estas condiciones, y al contrario que las proteínas, si realizáramos una electroforesis libre, observaríamos como todas las moléculas migrarían hacia el polo positivo con la misma velocidad al tener igual. Esta propiedad no nos sirve de mucho, pero hay que decir que en un soporte en gel, como los que vamos a utilizar, las moléculas de ácido nucleico se separan en función de su tamaño.
Soportes
Como ya he avanzado, la acrilamida se queda pequeña en la mayoría de las electroforesis de ácido nucleico, y es por lo que se utiliza otro tipo de soporte.
• Agarosa: polímero que funde a 80 - 90 ºC (aunque hay agarosas de muy diverso tipo, entre las que se encuentran las de bajo punto de fusión), y forman gel a unos 30 ºC. El rango de concentración oscila entre el 0,3 %, que puede separar moléculas del orden de 5 a 60 Kb, y el 2% que puede separar ácidos nucleicos de 0,1 a 0,2 Kb.
• Poliacrilamida: de la que ya hemos hablado y que para ácidos nucleicos ronda unas concentraciones del orden del 3,5%, con una capacidad separadora de 1.000 a 2.000 bases y del 20%, que puede diferenciar moléculas de 6 a 50 bases. Permite separar moléculas que sólo difieren en un solo nucleótido, que implica la utilización de geles de poliacrilamida en secuenciación.
AMINOACIDOS Y PROTEINAS
LAS PROTEINAS
Las proteínas son las moléculas orgánicas más abundantes en las células; constituyen más de el 50 % de su peso seco.
Cada proteína tiene funciones diferentes dentro de la célula. Además la mayor parte dela información genética transmitida por las proteínas.
Las proteínas son verdaderas macromoléculas que alcanzan dimensiones de las micelas en el estado coloidal. La estructurade tamaño micelar con cargas eléctricas en su superficie les confiere propiedades de absorción.
Las macromoléculas proteínicas en ocasiones están compuestas por una sola cadena polipeptídica; en tal caso reciben el nombre de monoméricas. Cuando la proteína esta formada por varias cadenas polipeptídicas que pueden o no ser idénticas entre sí, reciben el nombre de oligoméricas.
Las proteínas son macromoléculas por lo cual poseen pesos moleculares elevados. Todas producen por hidrolisis µ -aminoácidos.
Existen 20 µ -aminoácidos, como sillares para la formación de proteínas, enlazados por uniones cabeza-cola , llamadas : Enlace Polipeptídico.
Composición de las proteínas
Todas las proteínas contienen :
•Carbono
•Hidrógeno
•Nitrógeno
•Oxígeno
Y otros elementos tales como :
•Azufre
•Hierro
•Fósforo
•Cinc
Clasificación de las proteínas
Las proteínas pueden clasificarse, basándose en su :
•Composición
•Conformación
Según su composición, las proteínas se clasifican en :
•Proteínas Simples : Son aquellas que por hidrolisis, producen solamente µ -aminoácidos.
•Proteínas Conjugadas : Son aquellas que por hidrolisis, producen µ -amino-ácidosy además una serie de compuestos orgánicos e inorgánicos llamados : Grupo Prostético.
Las proteínas conjugadas pueden clasificarse de acuerdo a su grupo prostético :
•Nucleoproteínas (Ac. Nucleíco)
•Metaloproteínas (Metal)
•Fosfoproteínas (Fosfato)
•Glucoproteínas (Glucosa)
Según su conformación, las proteínas pueden clasificarse en :
•Proteínas Fibrosas : Son aquellas que se hayan constituídas por cadenas polipeptídicas, ordenadas de modo paralelo a lo largo de un eje formando estructuras compactas ( fibras o láminas).
Son materiales físicamente resistentes e insolubles en agua y soluciones salinas diluídas. Ej : (colágeno, µ -queratina, elastina).
•Proteínas Globulares : Están constituídas por cadenas polipeptídicas plegadas estrechamente, de modo que adoptan formas esféricas o globulares compactas.
Son solubles en sistemas acuosos, su función dentro de la célula es móvil y dinámica. Ej : (enzimas, anticuerpos, hormonas)
Existen proteínas que se encuentra entre las fibrosas por sus largas estructuras y las globulares por su solubilidad en las soluciones salinas. Ej : (miosina,fibrinógeno).
LOS PEPTIDOS
Los péptidos son un tipo de moléculas formadas por la unión de varios aminoácidos mediante enlaces peptídicos, o enlace triple con una conjugacion de ADN (ácido desoxirribonucleico)
Los péptidos, al igual que las proteínas, están presentes en la naturaleza y son responsables por un gran número de funciones, muchas de las cuales todavía no se conocen.
La unión de un bajo número de aminoácidos da lugar a un péptido:
Oligopéptido: menos de 10 aminoácidos.
Polipéptido: más de 10 aminoácidos.
Proteína: más de 100 aminoácidos. Las proteínas con una sola cadena polipeptídica se denominan proteínas monoméricas, mientras que las compuestas de más de una cadena polipeptídica se conocen como proteínas multiméricas.
Los péptidos se diferencian de las proteínas en que son más pequeños (tienen menos de diez mil o doce mil Daltons) y que las proteínas pueden estár formadas por la únión de varios polipéptidos y a veces grupos prostéticos. Un ejemplo de polipéptido es la insulina, compuesta de 55 aminoácidos y conocida como una hormona de acuerdo a la función que tiene en el organismo de los seres humanos.
ENLACE PEPTIDO
El enlace peptídico es un enlace covalente entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro aminoácido. Los péptidos y las proteínas están formados por la unión de aminoácidos mediante enlaces peptídicos. El enlace peptídico implica la pérdida de una molécula de agua y la formación de un enlace covalente CO-NH. Es, en realidad, un enlace amida sustituido.
Podemos seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal.
Para nombrar el péptido se empieza por el NH2 terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido alanil-serina.
ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS
La estructura tridimensional de las proteínas viene determinada por su secuencia de áá.
La función de una proteína depende de su estructura tridimensional
La estructura tridimensional de una proteína es única
Las fuerzas más importantes que estabilizan la estructura tridimensional son interacciones no covalentes.
La relación existente entre la secuencia de áá y la estructura de la proteína constituye aún una incógnita en algunos casos. Hay secuencias d áá muy diferentes que adoptan estructura similares, mientras que secuencias parecidas dan a veces estructuras diferentes.
La disposición espacial de los átomos de una proteína se denomina conformación. El término conformación se refiere a un estado estructural que puede interconvertirse con otros estados estructurales sin romper enlaces covalentes. Un cambio de conformación puede ser el resultado de la rotación de los enlaces sencillos. De entre las innumerables conformaciones posibles, siempre hay una que predomina, es la más estable.
Esquemáticamente se puede considerar que hay cuatro niveles estructurales:
Estructura primaria: incluye la secuencia de áá unidos por enlaces covalentes (peptídicos)
Estructura secundaria: corresponde a interacciones entre áá adyacentes. A menudo proteínas de tamaño grande tienen varios tipos de estructura secundaria
Estructura terciaria: corresponde a las interacciones de todos los áá
No siempre esta clara la frontera entre la secundaria y la terciaria.
Estructura cuaternaria implica relación entre varias cadenas polipeptídicas.
Los continuos avances en el estudio de las proteínas han hecho necesaria la definición de dos niveles estructurales adicionales a medio camino entre la estructura secundaria y la terciaria
La estructura supersecundaria son estructuras estables que se observan en muchas proteínas e incluso se repiten varias veces en una misma proteína.
El dominio son regiones mas compactas con funciones específicas.
Enlaces que estabilizan las conformaciones:
Covalentes: Puentes disulfuro
No covalentes: Interacciones hidrófobas, fuerzas de van der Waals, puentes de hidrógeno, interacciones iónicas.
A pesar de ser los enlaces covalentes mucho más fuertes son las interacciones débiles las que tienen más importancia como fuerza estabilizadora de la estructura de las proteínas gracias al gran nº en que se encuentra presentes. La conformación de la proteína es más estable cuando tiene mayor número de enlaces débiles.
La mayor parte de las estructuras obedecen a dos reglas:
1. los restos hidrófobos deben encontrarse enterrados en el interior de la proteína, lejos del contacto del agua
2. Debe formarse el mayor nº de puentes de hidrógeno
Las proteínas insolubles y aquellas que se localizan en la membrana siguen reglas diferentes a causa de la función que realizan y del entorno en que se encuentran.
Propiedades de las proteínas
Solubilidad: Se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH, se pierde la solubilidad.
Capacidad electrolítica: Se determina a través de la electroforesis, técnica analítica en la cual si las proteínas se trasladan al polo positivo es porque su molécula tiene carga negativa y viceversa.
Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
Amortiguador de pH (conocido como efecto tampón): Actúan como amortiguadores de pH debido a su carácter anfótero, es decir, pueden comportarse como ácidos (aceptando electrones) o como bases (donando electrones).
Funciones de las proteínas en nuestro organismo
Son el componente nitrogenado mayoritario de la dieta y el organismo, tienen una función meramente estructural o plástica, esto quiere decir que nos ayudan a construir y regenerar nuestros tejidos, no pudiendo ser reemplazadas por los carbohidratos o las grasas por no contener nitrógeno.
No obstante, además de esta función, también se caracterizan por:
Funciones reguladoras, Son materia prima para la formación de los jugos digestivos, hormonas, proteínas plasmáticas, hemoglobina, vitaminas y enzimas que llevan a cabo las reacciones químicas que se realizan en el organismo.
Las proteínas son defensivas, en la formación de anticuerpos y factores de regulación que actúan contra infecciones o agentes extraños.
De transporte, proteínas transportadoras de oxígeno en sangre como la hemoglobina.
En caso de necesidad también cumplen una función energética aportando 4 kcal. por gramo de energía al organismo.
Funcionan como amortiguadores, ayudando a mantener la reacción de diversos medios como el plasma.
Las proteínas actúan como catalizadores biológicos: son enzimas que aceleran la velocidad de las reacciones químicas del metabolismo.
La contracción muscular se realiza a través de la miosina y actina, proteínas contráctiles que permiten el movimiento celular.
Función de resistencia. Formación de la estructura del organismo y de tejidos de sostén y relleno como el conjuntivo, colágeno, elastina y reticulina.
Desnaturalización de una proteína
En bioquímica, la desnaturalización es un cambio estructural de las proteínas, donde pierden su estructura nativa, y de esta forma su óptimo funcionamiento y a veces también cambian sus propiedades físicas.
Las proteínas se desnaturalizan cuando pierden su estructura tridimensional (conformación química) y así su característico plegamiento de su estructura.
Las proteínas son filamentos largos de aminoácidos unidos en una secuencia específica. Son creadas por los ribosomas que "leen" codones de los genes y ensamblan la combinación requerida de aminoácidos por la instrucción genética. Las proteínas recién creadas experimentan una modificación en la que se agregan átomos o moléculas adicionales, como el cobre, zinc y hierro. Una vez que finaliza este proceso, la proteína comienza a plegarse sin alterar su secuencia (espontáneamente, y a veces con asistencia de enzimas) de forma tal que los elementos hidrofóbicos de la proteína son encerrados dentro de su estructura y los elementos hidrofílicos son llevados al exterior. La forma final de la proteína determina cómo interaccionará con el entorno.
Si la forma de la proteína es alterada por algún factor externo (por ejemplo, aplicándole calor, ácidos o álcalis), no es capaz de cumplir su función celular. Éste es el proceso llamado desnaturalización.
Cómo la desnaturalización afecta a los distintos niveles:
En la desnaturalización de la estructura cuaternaria, las subunidades de proteínas se separan o su posición espacial se corrompe.
La desnaturalización de la estrucutra terciaria implica la interrupción de:
Enlaces covalentes entre las cadenas laterales de los aminoácidos (como los puentes disulfuros entre las cisteínas).
Enlaces no covalentes dipolo-dipolo entre cadenas laterales polares de aminoácidos.
Enlaces dipolo inducidos por fuerzas de Van Der Waals entre cadenas laterales no polares de aminoácidos.
En la desnaturalización de la estructura secundaria las proteínas pierden todos los patrones de repetición regulares como las alfa-hélices y adoptan formas aleatorias.
La estrucutra primaria, la secuencia de aminoácidos ligados por enlaces peptídicos, no es interrumpida por las desnaturalización.
Pérdida de su función
La mayoría de las proteínas biológicas pierden su función biológica cuando están desnaturalizadas, por ejemplo, las enzimas pierden su actividad catalítica, porque los sustratos no pueden unirse más al sitio activo, y porque los residuos del aminoácido implicados en la estabilización de los sustratos no están posicionados para hacerlo.
Reversibilidad e irreversibilidad
En muchas proteínas (distinto a lo que pasa con la proteína de la clara de huevo), la desnaturalización es reversible (las proteínas pueden recuperar su estado nativo cuando se quita la influencia que las desnaturaliza). Esto fue importante históricamente, porque condujo a la noción que toda la información necesaria por la proteína para asumir su forma nativa, se encuentra codificada en la estructura primaria de la proteína, y por lo tanto en el ADN que la codifica.
Algunos ejemplos comunes
Cuando se cocina el alimento, algunas de sus proteínas se desnaturalizan. Esta es la razón por la cual los huevos hervidos llegan a ser duros y la carne cocinada llega a ser firme.
Un ejemplo clásico de desnaturalización de proteínas se da en la clara de los huevos, que son en gran parte albúminas en agua. En los huevos frescos, la clara es transparente y líquida; pero al cocinarse se torna opaca y blanca, formando una masa sólida intercomunicada. Esa misma desnaturalización puede producirse a través de una desnaturalización química, por ejemplo volcándola en un recipiente con acetona. Otro ejemplo es la nata (nombre que proviene de la desnaturalización), que se produce por calentamiento de la lactoalbúmina de la leche (y que no tiene nada que ver con la crema).
ELECTROFORESIS DE PROTEINASElectroforesis de Proteínas
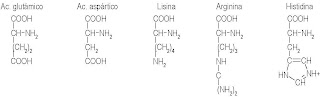
Las proteínas son moléculas cuya carga neta depende del contenido de una serie de aminoácidos (fundamentalmente ácido glutámico, ácido
aspártico, lisina, arginina e histidina) y del grado de ionización de éstos al pH considerado
Principales aminoácidos responsables de la carga neta de una proteína, dependiendo del pH
Las proteínas son las moléculas orgánicas más abundantes en las células; constituyen más de el 50 % de su peso seco.
Cada proteína tiene funciones diferentes dentro de la célula. Además la mayor parte dela información genética transmitida por las proteínas.
Las proteínas son verdaderas macromoléculas que alcanzan dimensiones de las micelas en el estado coloidal. La estructurade tamaño micelar con cargas eléctricas en su superficie les confiere propiedades de absorción.
Las macromoléculas proteínicas en ocasiones están compuestas por una sola cadena polipeptídica; en tal caso reciben el nombre de monoméricas. Cuando la proteína esta formada por varias cadenas polipeptídicas que pueden o no ser idénticas entre sí, reciben el nombre de oligoméricas.
Las proteínas son macromoléculas por lo cual poseen pesos moleculares elevados. Todas producen por hidrolisis µ -aminoácidos.
Existen 20 µ -aminoácidos, como sillares para la formación de proteínas, enlazados por uniones cabeza-cola , llamadas : Enlace Polipeptídico.
Composición de las proteínas
Todas las proteínas contienen :
•Carbono
•Hidrógeno
•Nitrógeno
•Oxígeno
Y otros elementos tales como :
•Azufre
•Hierro
•Fósforo
•Cinc
Clasificación de las proteínas
Las proteínas pueden clasificarse, basándose en su :
•Composición
•Conformación
Según su composición, las proteínas se clasifican en :
•Proteínas Simples : Son aquellas que por hidrolisis, producen solamente µ -aminoácidos.
•Proteínas Conjugadas : Son aquellas que por hidrolisis, producen µ -amino-ácidosy además una serie de compuestos orgánicos e inorgánicos llamados : Grupo Prostético.
Las proteínas conjugadas pueden clasificarse de acuerdo a su grupo prostético :
•Nucleoproteínas (Ac. Nucleíco)
•Metaloproteínas (Metal)
•Fosfoproteínas (Fosfato)
•Glucoproteínas (Glucosa)
Según su conformación, las proteínas pueden clasificarse en :
•Proteínas Fibrosas : Son aquellas que se hayan constituídas por cadenas polipeptídicas, ordenadas de modo paralelo a lo largo de un eje formando estructuras compactas ( fibras o láminas).
Son materiales físicamente resistentes e insolubles en agua y soluciones salinas diluídas. Ej : (colágeno, µ -queratina, elastina).
•Proteínas Globulares : Están constituídas por cadenas polipeptídicas plegadas estrechamente, de modo que adoptan formas esféricas o globulares compactas.
Son solubles en sistemas acuosos, su función dentro de la célula es móvil y dinámica. Ej : (enzimas, anticuerpos, hormonas)
Existen proteínas que se encuentra entre las fibrosas por sus largas estructuras y las globulares por su solubilidad en las soluciones salinas. Ej : (miosina,fibrinógeno).
LOS PEPTIDOS
Los péptidos son un tipo de moléculas formadas por la unión de varios aminoácidos mediante enlaces peptídicos, o enlace triple con una conjugacion de ADN (ácido desoxirribonucleico)
Los péptidos, al igual que las proteínas, están presentes en la naturaleza y son responsables por un gran número de funciones, muchas de las cuales todavía no se conocen.
La unión de un bajo número de aminoácidos da lugar a un péptido:
Oligopéptido: menos de 10 aminoácidos.
Polipéptido: más de 10 aminoácidos.
Proteína: más de 100 aminoácidos. Las proteínas con una sola cadena polipeptídica se denominan proteínas monoméricas, mientras que las compuestas de más de una cadena polipeptídica se conocen como proteínas multiméricas.
Los péptidos se diferencian de las proteínas en que son más pequeños (tienen menos de diez mil o doce mil Daltons) y que las proteínas pueden estár formadas por la únión de varios polipéptidos y a veces grupos prostéticos. Un ejemplo de polipéptido es la insulina, compuesta de 55 aminoácidos y conocida como una hormona de acuerdo a la función que tiene en el organismo de los seres humanos.
ENLACE PEPTIDO
El enlace peptídico es un enlace covalente entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro aminoácido. Los péptidos y las proteínas están formados por la unión de aminoácidos mediante enlaces peptídicos. El enlace peptídico implica la pérdida de una molécula de agua y la formación de un enlace covalente CO-NH. Es, en realidad, un enlace amida sustituido.
Podemos seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal.
Para nombrar el péptido se empieza por el NH2 terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido alanil-serina.
ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS
La estructura tridimensional de las proteínas viene determinada por su secuencia de áá.
La función de una proteína depende de su estructura tridimensional
La estructura tridimensional de una proteína es única
Las fuerzas más importantes que estabilizan la estructura tridimensional son interacciones no covalentes.
La relación existente entre la secuencia de áá y la estructura de la proteína constituye aún una incógnita en algunos casos. Hay secuencias d áá muy diferentes que adoptan estructura similares, mientras que secuencias parecidas dan a veces estructuras diferentes.
La disposición espacial de los átomos de una proteína se denomina conformación. El término conformación se refiere a un estado estructural que puede interconvertirse con otros estados estructurales sin romper enlaces covalentes. Un cambio de conformación puede ser el resultado de la rotación de los enlaces sencillos. De entre las innumerables conformaciones posibles, siempre hay una que predomina, es la más estable.
Esquemáticamente se puede considerar que hay cuatro niveles estructurales:
Estructura primaria: incluye la secuencia de áá unidos por enlaces covalentes (peptídicos)
Estructura secundaria: corresponde a interacciones entre áá adyacentes. A menudo proteínas de tamaño grande tienen varios tipos de estructura secundaria
Estructura terciaria: corresponde a las interacciones de todos los áá
No siempre esta clara la frontera entre la secundaria y la terciaria.
Estructura cuaternaria implica relación entre varias cadenas polipeptídicas.
Los continuos avances en el estudio de las proteínas han hecho necesaria la definición de dos niveles estructurales adicionales a medio camino entre la estructura secundaria y la terciaria
La estructura supersecundaria son estructuras estables que se observan en muchas proteínas e incluso se repiten varias veces en una misma proteína.
El dominio son regiones mas compactas con funciones específicas.
Enlaces que estabilizan las conformaciones:
Covalentes: Puentes disulfuro
No covalentes: Interacciones hidrófobas, fuerzas de van der Waals, puentes de hidrógeno, interacciones iónicas.
A pesar de ser los enlaces covalentes mucho más fuertes son las interacciones débiles las que tienen más importancia como fuerza estabilizadora de la estructura de las proteínas gracias al gran nº en que se encuentra presentes. La conformación de la proteína es más estable cuando tiene mayor número de enlaces débiles.
La mayor parte de las estructuras obedecen a dos reglas:
1. los restos hidrófobos deben encontrarse enterrados en el interior de la proteína, lejos del contacto del agua
2. Debe formarse el mayor nº de puentes de hidrógeno
Las proteínas insolubles y aquellas que se localizan en la membrana siguen reglas diferentes a causa de la función que realizan y del entorno en que se encuentran.
Propiedades de las proteínas
Solubilidad: Se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH, se pierde la solubilidad.
Capacidad electrolítica: Se determina a través de la electroforesis, técnica analítica en la cual si las proteínas se trasladan al polo positivo es porque su molécula tiene carga negativa y viceversa.
Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
Amortiguador de pH (conocido como efecto tampón): Actúan como amortiguadores de pH debido a su carácter anfótero, es decir, pueden comportarse como ácidos (aceptando electrones) o como bases (donando electrones).
Funciones de las proteínas en nuestro organismo
Son el componente nitrogenado mayoritario de la dieta y el organismo, tienen una función meramente estructural o plástica, esto quiere decir que nos ayudan a construir y regenerar nuestros tejidos, no pudiendo ser reemplazadas por los carbohidratos o las grasas por no contener nitrógeno.
No obstante, además de esta función, también se caracterizan por:
Funciones reguladoras, Son materia prima para la formación de los jugos digestivos, hormonas, proteínas plasmáticas, hemoglobina, vitaminas y enzimas que llevan a cabo las reacciones químicas que se realizan en el organismo.
Las proteínas son defensivas, en la formación de anticuerpos y factores de regulación que actúan contra infecciones o agentes extraños.
De transporte, proteínas transportadoras de oxígeno en sangre como la hemoglobina.
En caso de necesidad también cumplen una función energética aportando 4 kcal. por gramo de energía al organismo.
Funcionan como amortiguadores, ayudando a mantener la reacción de diversos medios como el plasma.
Las proteínas actúan como catalizadores biológicos: son enzimas que aceleran la velocidad de las reacciones químicas del metabolismo.
La contracción muscular se realiza a través de la miosina y actina, proteínas contráctiles que permiten el movimiento celular.
Función de resistencia. Formación de la estructura del organismo y de tejidos de sostén y relleno como el conjuntivo, colágeno, elastina y reticulina.
Desnaturalización de una proteína
En bioquímica, la desnaturalización es un cambio estructural de las proteínas, donde pierden su estructura nativa, y de esta forma su óptimo funcionamiento y a veces también cambian sus propiedades físicas.
Las proteínas se desnaturalizan cuando pierden su estructura tridimensional (conformación química) y así su característico plegamiento de su estructura.
Las proteínas son filamentos largos de aminoácidos unidos en una secuencia específica. Son creadas por los ribosomas que "leen" codones de los genes y ensamblan la combinación requerida de aminoácidos por la instrucción genética. Las proteínas recién creadas experimentan una modificación en la que se agregan átomos o moléculas adicionales, como el cobre, zinc y hierro. Una vez que finaliza este proceso, la proteína comienza a plegarse sin alterar su secuencia (espontáneamente, y a veces con asistencia de enzimas) de forma tal que los elementos hidrofóbicos de la proteína son encerrados dentro de su estructura y los elementos hidrofílicos son llevados al exterior. La forma final de la proteína determina cómo interaccionará con el entorno.
Si la forma de la proteína es alterada por algún factor externo (por ejemplo, aplicándole calor, ácidos o álcalis), no es capaz de cumplir su función celular. Éste es el proceso llamado desnaturalización.
Cómo la desnaturalización afecta a los distintos niveles:
En la desnaturalización de la estructura cuaternaria, las subunidades de proteínas se separan o su posición espacial se corrompe.
La desnaturalización de la estrucutra terciaria implica la interrupción de:
Enlaces covalentes entre las cadenas laterales de los aminoácidos (como los puentes disulfuros entre las cisteínas).
Enlaces no covalentes dipolo-dipolo entre cadenas laterales polares de aminoácidos.
Enlaces dipolo inducidos por fuerzas de Van Der Waals entre cadenas laterales no polares de aminoácidos.
En la desnaturalización de la estructura secundaria las proteínas pierden todos los patrones de repetición regulares como las alfa-hélices y adoptan formas aleatorias.
La estrucutra primaria, la secuencia de aminoácidos ligados por enlaces peptídicos, no es interrumpida por las desnaturalización.
Pérdida de su función
La mayoría de las proteínas biológicas pierden su función biológica cuando están desnaturalizadas, por ejemplo, las enzimas pierden su actividad catalítica, porque los sustratos no pueden unirse más al sitio activo, y porque los residuos del aminoácido implicados en la estabilización de los sustratos no están posicionados para hacerlo.
Reversibilidad e irreversibilidad
En muchas proteínas (distinto a lo que pasa con la proteína de la clara de huevo), la desnaturalización es reversible (las proteínas pueden recuperar su estado nativo cuando se quita la influencia que las desnaturaliza). Esto fue importante históricamente, porque condujo a la noción que toda la información necesaria por la proteína para asumir su forma nativa, se encuentra codificada en la estructura primaria de la proteína, y por lo tanto en el ADN que la codifica.
Algunos ejemplos comunes
Cuando se cocina el alimento, algunas de sus proteínas se desnaturalizan. Esta es la razón por la cual los huevos hervidos llegan a ser duros y la carne cocinada llega a ser firme.
Un ejemplo clásico de desnaturalización de proteínas se da en la clara de los huevos, que son en gran parte albúminas en agua. En los huevos frescos, la clara es transparente y líquida; pero al cocinarse se torna opaca y blanca, formando una masa sólida intercomunicada. Esa misma desnaturalización puede producirse a través de una desnaturalización química, por ejemplo volcándola en un recipiente con acetona. Otro ejemplo es la nata (nombre que proviene de la desnaturalización), que se produce por calentamiento de la lactoalbúmina de la leche (y que no tiene nada que ver con la crema).
ELECTROFORESIS DE PROTEINASElectroforesis de Proteínas
Las proteínas son moléculas cuya carga neta depende del contenido de una serie de aminoácidos (fundamentalmente ácido glutámico, ácido
aspártico, lisina, arginina e histidina) y del grado de ionización de éstos al pH considerado
Principales aminoácidos responsables de la carga neta de una proteína, dependiendo del pH
Suscribirse a:
Comentarios (Atom)