Bioelementos primarios o principales: C, H, O, N
Son los elementos mayoritarios de la materia viva, constituyen el 95% de la masa total.
Las propiedades físico-químicas que los hacen idóneos son las siguientes:
Forman entre ellos enlaces covalentes, compartiendo electrones.El carbono, nitrógeno y oxígeno, pueden compartir más de un par de electrones, formando enlaces dobles y triples, lo cual les dota de una gran versatilidad para el enlace químico
Son los elementos más ligeros con capacidad de formar enlace covalente, por lo que dichos enlaces son muy estables.
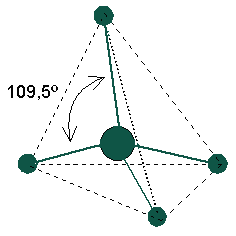
A causa configuración tetraédrica de los enlaces del carbono, los diferentes tipos de moléculas orgánicas tienen estructuras tridimensionales diferentes .
Esta conformación espacial es responsable de la actividad biológica.
Las combinaciones del carbono con otros elementos, como el oxígeno, el hidrógeno, el nitrógeno, etc.,
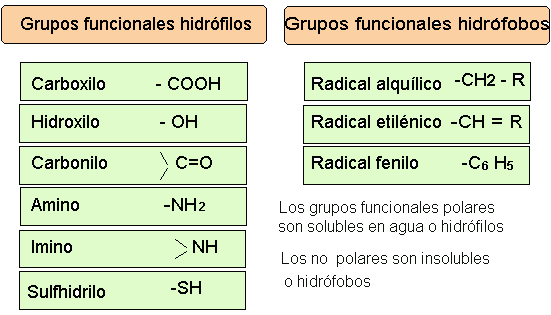
permiten la aparición de una gran variedad de grupos funcionales que dan lugar a las diferentes familias de sustancias orgánicas . Estos presentan características físicas y químicas diferentes, y dan a las moléculas orgánicas propiedades específicas, lo que aumenta las posibilidades de cración de nuevas moléculas orgánicas por reacción entre los diferentes grupos.
Los enlaces entre los átomos de carbono pueden ser simples (C - C), dobles (C = C) o triples
lo que permite que puedan formarse cadenas más o menos largas, lineales, ramificadas y anillos.
Bioelementos secundarios S, P, Mg, Ca, Na, K, Cl
Los encontramos formando parte de todos los seres vivos, y en una proporción del 4,5%.
Azufre
Se encuentra en dos aminoácidos (cisteína y metionina) , presentes en todas las proteínas. También en algunas sustancias como el Coenzima A
Fósforo
Forma parte de los nucleótidos, compuestos que forman los ácidos nucléicos. Forman parte de coenzimas y otras moléculas como fosfolípidos, sustancias fundamentales de las membranas celulares. También forma parte de los fosfatos, sales minerales abundantes en los seres vivos.
Magnesio
Forma parte de la molécula de clorofila, y en forma iónica actúa como catalizador, junto con las enzimas , en muchas reacciones químicas del organismo.
Calcio
Forma parte de los carbonatos de calcio de estructuras esqueléticas. En forma iónica interviene en la contracción muscular, coagulación sanguínea y transmisión del impulso nervioso.
Sodio
Catión abundante en el medio extracelular; necesario para la conducción nerviosa y la contracción muscular
Potasio
Catión más abundante en el interior de las células; necesario para la conducción nerviosa y la contracción muscular
Cloro
Anión más frecuente; necesario para mantener el balance de agua en la sangre y fluído intersticial.
Oligoelementos
Se denominan así al conjunto de elementos químicos que están presentes en los organismos en forma vestigial, pero que son indispensables para el desarrollo armónico del organismo.
Se han aislado unos 60 oligoelementos en los seres vivos, pero solamente 14 de ellos pueden considerarse comunes para casi todos, y estos son: hierro, manganeso, cobre, zinc, flúor, iodo, boro, silicio, vanadio, cromo, cobalto, selenio, molibdeno y estaño. Las funciones que desempeñan, quedan reflejadas en el siguiente cuadro:
Hierro
Fundamental para la síntesis de clorofila, catalizador en reacciones químicas y formando parte de citocromos que intervienen en la respiración celular, y en la hemoglobina que interviene en el transporte de oxígeno.
Manganeso
Interviene en la fotolisis del agua , durante el proceso de fotosíntesis en las plantas.
Iodo
Necesario para la síntesis de la tiroxina, hormona que interviene en el metabolismo
Flúor
Forma parte del esmalte dentario y de los huesos.
Cobalto
Forma parte de la vitamina B12, necesaria para la síntesis de hemoglobina .
Silicio
Proporciona resistencia al tejido conjuntivo, endurece tejidos vegetales como en las gramíneas.
Cromo
Interviene junto a la insulina en la regulación de glucosa en sangre.
Zinc
Actúa como catalizador en muchas reacciones del organismo.
Litio
Actúa sobre neurotransmisores y la permeabilidad celular. En dosis adecuada puede prevenir estados de depresiones.
Molibdeno
Forma parte de las enzimas vegetales que actúan en la reducción de los nitratos por parte de las planta
PROPIEDADES FISICO QUIMICAS DEL AGUA
El agua presenta las siguientes propiedades físico-químicas:
a) Acción disolvente. El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosos.
b) Fuerza de cohesión entre sus moléculas. Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible.
c) Elevada fuerza de adhesión.
De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión de la capilaridad, al cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
d) Gran calor específico.
El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciende más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de protección para las moléculas orgánicas en los cambios bruscos de temperatura.
e) Elevado calor de vaporización. A 20ºC se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.
f) Elevada constante dieléctrica.
Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.g) Bajo grado de ionización.
De cada 107 de moléculas de agua, sólo una se encuentra ionizada.
De cada 107 de moléculas de agua, sólo una se encuentra ionizada.
H2O H3O+ + OH-
Esto explica que la concentración de iones hidronio (H3O+) y de los iones hidroxilo (OH-) sea muy baja. Dado los bajos niveles de H3O+ y de OH-, si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente.
Las sales minerales
son biomoléculas inorgánicas que aparecen en los seres vivos de forma precipitada, disuelta en forma de iones o asociada a otras moléculas.
Precipitadas
Las sales se forman por unión de un ácido con una base, liberando agua. En forma precipitada forman estructuras duras, que proporcionan estructura o protección al ser que las posee. Ejemplos son las conchas, los caparazones o los esqueletos.
Disueltas
Las sales disueltas en agua manifiestan cargas positivas o negativas. Los cationes más abundantes en la composición de los seres vivos son Na+, K+, Ca2+, Mg2+... Los aniones más representativos en la composición de los seres vivos son Cl-, PO43-, CO32-... Las sales disueltas en agua pueden realizar funciones tales como:
Mantener el grado de grado de salinidad.
Amortiguar cambios de pH, mediante el efecto tampón.
Controlar la contracción muscular
Producir gradientes electroquímicos
Estabilizar dispersiones coloidales.
Asociadas a otras moléculas
Los iones pueden asociarse a moléculas, permitiendo realizar funciones que, por sí solos no podrían, y que tampoco realizaría la molécula a la que se asocia, si no tuviera el ión. La hemoglobina es capaz de transportar oxígeno por la sangre porque está unida a un ión Fe++. Los citocromos actúan como transportadores de electrones porque poseen un ión Fe+++. La clorofila captura energía luminosa en el proceso de fotosíntesis por contener un ión Mg++ en su estructura.
La mutarrotación
Es un fenómeno de isomerización que ocurre en monosacáridos referido a la rotación que sufre el carbono anomérico al pasar de un confórmero al otro. Puede pasar de un enlace de carbono alfa a uno beta, o viceversa. En la serie "D",por convencion si la disposicion del OH es hacia arriba lo llamamos beta, si es hacia abajo lo denominamos alfa, ocurriendo lo contrario en la serie "L", donde el OH hacia arriba indica el confórmero alfa, y hacia abajo, el beta. Para pasar de un estado al otro debe pasar primero por el estado de cadena abierta.
Por tratarse de una rotación de sustituyentes que sufre el carbono anomérico al pasar de un confórmero al otro, se concluye que el compuesto cambia su actividad óptica. El compuesto el original y resultante son isomeros opticos entre si.
COMPOSICIÓN Y NOMENCLATURA
Según posean la función aldehído o cetona, se clasifican en dos familias: en el primer caso se denominan aldosas (poseen la función aldehído en el primer carbono), y en el segundo cetosas (localizándose el grupo cetona en el segundo carbono, siempre).
Dentro de cada familia, se clasifican en distintos grupos, dependiendo del número de átomos que posean, se nombran anteponiendo el prefijo aldo- o ceto- al prefijo que indica el número de carbono (tri-, tetra, etc) y añadiendo el sufijo -osa. Se denominan triosas (3 átomos de carbono), tetrosas (4), pentosas (5), hexosas (6), heptosa (7).
Por ejemplo, si tienen tres átomos (C3H6O3) serian:
H-C= O CH2OH
H-C-OH C= O
CH2OH Aldotriosa CH2OH Cetotriosa
FURANOS Y PIRANOS
Los monosacaridos cíclicos
Determinados azúcares en disoluciones, no se encuentran en sus formas de cadena abierta ya que dicha conformación no es tan estable, energéticamente hablando, como la forma cíclica que es la que se observa mayoritariamente. Estos anillos se forman gracias a que entre un aldehído y un grupo alcohol puede formarse un enlace hemiacetal.
Por ejemplo; en la glucosa (una aldosa) su C1 aldehído reacciona con un grupo hidroxilo del C5 formando un hemiacetal intramolecular. El anillo resultante de seis carbonos se denomina piranosa por su parecido con el pirano.
Otro ejemplo es la fructosa (una cetohexosa); el grupo ceto del C2 puede formar un hemiacetal intramolecular con el hidoxilo del C6 (formando un anillo de 6 miembros) o con el hidroxilo del C5 (formando un anillo de 5 miembros) dando origen a una fructopiranosa o a una fructofuranosa respectivamente (gracias biochemistryquestions por la corrección).
A las representaciones de los anillos de furanos y piranos se las denomina proyeccciones de Haworth; en ellas no se representan los átomos de carbono explícitamente, el plano sería prependicular al papel, con la línea más gruesa proyectada hacia el mismo. La configuración α indica que el grupo hidroxilo del C1 está anclado en el lado opuesto del CH2OH del carbono que determina si el azúcar es D o L. La configuración β es aquella en la que el grupo hidroxilo está en el mismo lado que el CH2OH del centro quiral. Al C1 se le denomina carbono anomérico y a las formas α y β: anómeros. Estas formas se encuentran en nuestro cuerpo siguiendo la siguiente relación:
1/3 α
2/3 β
1% en forma de cadena abierta







No hay comentarios:
Publicar un comentario