LAS PROTEINAS
Las proteínas son las moléculas orgánicas más abundantes en las células; constituyen más de el 50 % de su peso seco.
Cada proteína tiene funciones diferentes dentro de la célula. Además la mayor parte dela información genética transmitida por las proteínas.
Las proteínas son verdaderas macromoléculas que alcanzan dimensiones de las micelas en el estado coloidal. La estructurade tamaño micelar con cargas eléctricas en su superficie les confiere propiedades de absorción.
Las macromoléculas proteínicas en ocasiones están compuestas por una sola cadena polipeptídica; en tal caso reciben el nombre de monoméricas. Cuando la proteína esta formada por varias cadenas polipeptídicas que pueden o no ser idénticas entre sí, reciben el nombre de oligoméricas.
Las proteínas son macromoléculas por lo cual poseen pesos moleculares elevados. Todas producen por hidrolisis µ -aminoácidos.
Existen 20 µ -aminoácidos, como sillares para la formación de proteínas, enlazados por uniones cabeza-cola , llamadas : Enlace Polipeptídico.
Composición de las proteínas
Todas las proteínas contienen :
•Carbono
•Hidrógeno
•Nitrógeno
•Oxígeno
Y otros elementos tales como :
•Azufre
•Hierro
•Fósforo
•Cinc
Clasificación de las proteínas
Las proteínas pueden clasificarse, basándose en su :
•Composición
•Conformación
Según su composición, las proteínas se clasifican en :
•Proteínas Simples : Son aquellas que por hidrolisis, producen solamente µ -aminoácidos.
•Proteínas Conjugadas : Son aquellas que por hidrolisis, producen µ -amino-ácidosy además una serie de compuestos orgánicos e inorgánicos llamados : Grupo Prostético.
Las proteínas conjugadas pueden clasificarse de acuerdo a su grupo prostético :
•Nucleoproteínas (Ac. Nucleíco)
•Metaloproteínas (Metal)
•Fosfoproteínas (Fosfato)
•Glucoproteínas (Glucosa)
Según su conformación, las proteínas pueden clasificarse en :
•Proteínas Fibrosas : Son aquellas que se hayan constituídas por cadenas polipeptídicas, ordenadas de modo paralelo a lo largo de un eje formando estructuras compactas ( fibras o láminas).
Son materiales físicamente resistentes e insolubles en agua y soluciones salinas diluídas. Ej : (colágeno, µ -queratina, elastina).
•Proteínas Globulares : Están constituídas por cadenas polipeptídicas plegadas estrechamente, de modo que adoptan formas esféricas o globulares compactas.
Son solubles en sistemas acuosos, su función dentro de la célula es móvil y dinámica. Ej : (enzimas, anticuerpos, hormonas)
Existen proteínas que se encuentra entre las fibrosas por sus largas estructuras y las globulares por su solubilidad en las soluciones salinas. Ej : (miosina,fibrinógeno).
LOS PEPTIDOS
Los péptidos son un tipo de moléculas formadas por la unión de varios aminoácidos mediante enlaces peptídicos, o enlace triple con una conjugacion de ADN (ácido desoxirribonucleico)
Los péptidos, al igual que las proteínas, están presentes en la naturaleza y son responsables por un gran número de funciones, muchas de las cuales todavía no se conocen.
La unión de un bajo número de aminoácidos da lugar a un péptido:
Oligopéptido: menos de 10 aminoácidos.
Polipéptido: más de 10 aminoácidos.
Proteína: más de 100 aminoácidos. Las proteínas con una sola cadena polipeptídica se denominan proteínas monoméricas, mientras que las compuestas de más de una cadena polipeptídica se conocen como proteínas multiméricas.
Los péptidos se diferencian de las proteínas en que son más pequeños (tienen menos de diez mil o doce mil Daltons) y que las proteínas pueden estár formadas por la únión de varios polipéptidos y a veces grupos prostéticos. Un ejemplo de polipéptido es la insulina, compuesta de 55 aminoácidos y conocida como una hormona de acuerdo a la función que tiene en el organismo de los seres humanos.
ENLACE PEPTIDO
El enlace peptídico es un enlace covalente entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro aminoácido. Los péptidos y las proteínas están formados por la unión de aminoácidos mediante enlaces peptídicos. El enlace peptídico implica la pérdida de una molécula de agua y la formación de un enlace covalente CO-NH. Es, en realidad, un enlace amida sustituido.
Podemos seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal.
Para nombrar el péptido se empieza por el NH2 terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido alanil-serina.
ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS
La estructura tridimensional de las proteínas viene determinada por su secuencia de áá.
La función de una proteína depende de su estructura tridimensional
La estructura tridimensional de una proteína es única
Las fuerzas más importantes que estabilizan la estructura tridimensional son interacciones no covalentes.
La relación existente entre la secuencia de áá y la estructura de la proteína constituye aún una incógnita en algunos casos. Hay secuencias d áá muy diferentes que adoptan estructura similares, mientras que secuencias parecidas dan a veces estructuras diferentes.
La disposición espacial de los átomos de una proteína se denomina conformación. El término conformación se refiere a un estado estructural que puede interconvertirse con otros estados estructurales sin romper enlaces covalentes. Un cambio de conformación puede ser el resultado de la rotación de los enlaces sencillos. De entre las innumerables conformaciones posibles, siempre hay una que predomina, es la más estable.
Esquemáticamente se puede considerar que hay cuatro niveles estructurales:
Estructura primaria: incluye la secuencia de áá unidos por enlaces covalentes (peptídicos)
Estructura secundaria: corresponde a interacciones entre áá adyacentes. A menudo proteínas de tamaño grande tienen varios tipos de estructura secundaria
Estructura terciaria: corresponde a las interacciones de todos los áá
No siempre esta clara la frontera entre la secundaria y la terciaria.
Estructura cuaternaria implica relación entre varias cadenas polipeptídicas.
Los continuos avances en el estudio de las proteínas han hecho necesaria la definición de dos niveles estructurales adicionales a medio camino entre la estructura secundaria y la terciaria
La estructura supersecundaria son estructuras estables que se observan en muchas proteínas e incluso se repiten varias veces en una misma proteína.
El dominio son regiones mas compactas con funciones específicas.
Enlaces que estabilizan las conformaciones:
Covalentes: Puentes disulfuro
No covalentes: Interacciones hidrófobas, fuerzas de van der Waals, puentes de hidrógeno, interacciones iónicas.
A pesar de ser los enlaces covalentes mucho más fuertes son las interacciones débiles las que tienen más importancia como fuerza estabilizadora de la estructura de las proteínas gracias al gran nº en que se encuentra presentes. La conformación de la proteína es más estable cuando tiene mayor número de enlaces débiles.
La mayor parte de las estructuras obedecen a dos reglas:
1. los restos hidrófobos deben encontrarse enterrados en el interior de la proteína, lejos del contacto del agua
2. Debe formarse el mayor nº de puentes de hidrógeno
Las proteínas insolubles y aquellas que se localizan en la membrana siguen reglas diferentes a causa de la función que realizan y del entorno en que se encuentran.
Propiedades de las proteínas
Solubilidad: Se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH, se pierde la solubilidad.
Capacidad electrolítica: Se determina a través de la electroforesis, técnica analítica en la cual si las proteínas se trasladan al polo positivo es porque su molécula tiene carga negativa y viceversa.
Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
Amortiguador de pH (conocido como efecto tampón): Actúan como amortiguadores de pH debido a su carácter anfótero, es decir, pueden comportarse como ácidos (aceptando electrones) o como bases (donando electrones).
Funciones de las proteínas en nuestro organismo
Son el componente nitrogenado mayoritario de la dieta y el organismo, tienen una función meramente estructural o plástica, esto quiere decir que nos ayudan a construir y regenerar nuestros tejidos, no pudiendo ser reemplazadas por los carbohidratos o las grasas por no contener nitrógeno.
No obstante, además de esta función, también se caracterizan por:
Funciones reguladoras, Son materia prima para la formación de los jugos digestivos, hormonas, proteínas plasmáticas, hemoglobina, vitaminas y enzimas que llevan a cabo las reacciones químicas que se realizan en el organismo.
Las proteínas son defensivas, en la formación de anticuerpos y factores de regulación que actúan contra infecciones o agentes extraños.
De transporte, proteínas transportadoras de oxígeno en sangre como la hemoglobina.
En caso de necesidad también cumplen una función energética aportando 4 kcal. por gramo de energía al organismo.
Funcionan como amortiguadores, ayudando a mantener la reacción de diversos medios como el plasma.
Las proteínas actúan como catalizadores biológicos: son enzimas que aceleran la velocidad de las reacciones químicas del metabolismo.
La contracción muscular se realiza a través de la miosina y actina, proteínas contráctiles que permiten el movimiento celular.
Función de resistencia. Formación de la estructura del organismo y de tejidos de sostén y relleno como el conjuntivo, colágeno, elastina y reticulina.
Desnaturalización de una proteína
En bioquímica, la desnaturalización es un cambio estructural de las proteínas, donde pierden su estructura nativa, y de esta forma su óptimo funcionamiento y a veces también cambian sus propiedades físicas.
Las proteínas se desnaturalizan cuando pierden su estructura tridimensional (conformación química) y así su característico plegamiento de su estructura.
Las proteínas son filamentos largos de aminoácidos unidos en una secuencia específica. Son creadas por los ribosomas que "leen" codones de los genes y ensamblan la combinación requerida de aminoácidos por la instrucción genética. Las proteínas recién creadas experimentan una modificación en la que se agregan átomos o moléculas adicionales, como el cobre, zinc y hierro. Una vez que finaliza este proceso, la proteína comienza a plegarse sin alterar su secuencia (espontáneamente, y a veces con asistencia de enzimas) de forma tal que los elementos hidrofóbicos de la proteína son encerrados dentro de su estructura y los elementos hidrofílicos son llevados al exterior. La forma final de la proteína determina cómo interaccionará con el entorno.
Si la forma de la proteína es alterada por algún factor externo (por ejemplo, aplicándole calor, ácidos o álcalis), no es capaz de cumplir su función celular. Éste es el proceso llamado desnaturalización.
Cómo la desnaturalización afecta a los distintos niveles:
En la desnaturalización de la estructura cuaternaria, las subunidades de proteínas se separan o su posición espacial se corrompe.
La desnaturalización de la estrucutra terciaria implica la interrupción de:
Enlaces covalentes entre las cadenas laterales de los aminoácidos (como los puentes disulfuros entre las cisteínas).
Enlaces no covalentes dipolo-dipolo entre cadenas laterales polares de aminoácidos.
Enlaces dipolo inducidos por fuerzas de Van Der Waals entre cadenas laterales no polares de aminoácidos.
En la desnaturalización de la estructura secundaria las proteínas pierden todos los patrones de repetición regulares como las alfa-hélices y adoptan formas aleatorias.
La estrucutra primaria, la secuencia de aminoácidos ligados por enlaces peptídicos, no es interrumpida por las desnaturalización.
Pérdida de su función
La mayoría de las proteínas biológicas pierden su función biológica cuando están desnaturalizadas, por ejemplo, las enzimas pierden su actividad catalítica, porque los sustratos no pueden unirse más al sitio activo, y porque los residuos del aminoácido implicados en la estabilización de los sustratos no están posicionados para hacerlo.
Reversibilidad e irreversibilidad
En muchas proteínas (distinto a lo que pasa con la proteína de la clara de huevo), la desnaturalización es reversible (las proteínas pueden recuperar su estado nativo cuando se quita la influencia que las desnaturaliza). Esto fue importante históricamente, porque condujo a la noción que toda la información necesaria por la proteína para asumir su forma nativa, se encuentra codificada en la estructura primaria de la proteína, y por lo tanto en el ADN que la codifica.
Algunos ejemplos comunes
Cuando se cocina el alimento, algunas de sus proteínas se desnaturalizan. Esta es la razón por la cual los huevos hervidos llegan a ser duros y la carne cocinada llega a ser firme.
Un ejemplo clásico de desnaturalización de proteínas se da en la clara de los huevos, que son en gran parte albúminas en agua. En los huevos frescos, la clara es transparente y líquida; pero al cocinarse se torna opaca y blanca, formando una masa sólida intercomunicada. Esa misma desnaturalización puede producirse a través de una desnaturalización química, por ejemplo volcándola en un recipiente con acetona. Otro ejemplo es la nata (nombre que proviene de la desnaturalización), que se produce por calentamiento de la lactoalbúmina de la leche (y que no tiene nada que ver con la crema).
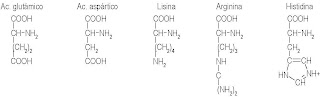
ELECTROFORESIS DE PROTEINASElectroforesis de Proteínas
Las proteínas son moléculas cuya carga neta depende del contenido de una serie de aminoácidos (fundamentalmente ácido glutámico, ácido
aspártico, lisina, arginina e histidina) y del grado de ionización de éstos al pH considerado
Principales aminoácidos responsables de la carga neta de una proteína, dependiendo del pH


No hay comentarios:
Publicar un comentario